การวิเคราะห์ปริมาตรหรือปริมาตร volume มันคือ ขั้นตอนทางห้องปฏิบัติการที่เราใช้ปริมาณ a สารละลาย ใน ความเข้มข้น ทราบเพื่อกำหนดความเข้มข้นของสารละลายอื่น ปริมาตรของสารละลายของความเข้มข้นที่ทราบจะถูกกำหนดเมื่อทำปฏิกิริยาอย่างสมบูรณ์กับสารละลายที่มีความเข้มข้นที่ไม่ทราบสาเหตุ กล่าวคือ สารละลายที่เกี่ยวข้องจะต้องทำปฏิกิริยาซึ่งกันและกัน
เครื่องมือที่ใช้มากที่สุดในการวัดปริมาตรที่กำหนดคือ:
- ปิเปต

ตัวอย่างปิเปตที่ใช้ในการวัดปริมาตร
- บิวเรต

บิวเรตต์เป็นอุปกรณ์วัดปริมาตรที่สำคัญ
การวัดปริมาตรทำโดยการประเมินความสูงของวงเดือนที่เรียกว่าซึ่งไม่มีอะไรมากไปกว่าพื้นที่ผิวของของเหลวซึ่งมีลักษณะเป็นรูปสี่เหลี่ยมผืนผ้าหรือโดม (รูปทรงหยดน้ำ) ขึ้นอยู่กับความหนาของภาชนะ ยิ่งภาชนะกว้างเท่าไหร่วงเดือนก็จะยิ่งเป็นรูปสี่เหลี่ยมผืนผ้ามากขึ้น ยิ่งภาชนะยิ่งบางก็ยิ่งนูน ในการประเมินวงเดือน ตาจะต้องอยู่ที่ระดับความสูงพอดี และเราต้องใช้ส่วนล่างเป็นข้อมูลอ้างอิง หากวงเดือนเป็นรูปสี่เหลี่ยมผืนผ้า หรือส่วนปลาย ถ้าโป่ง ดูการแสดงการประเมิน:
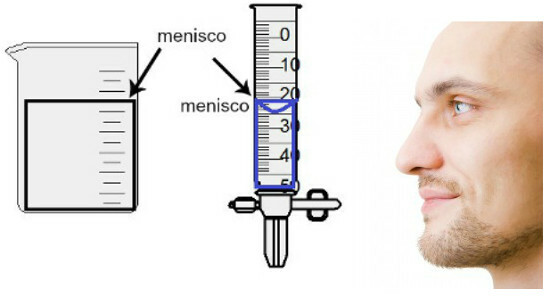
ในการประเมินวงเดือน สิ่งสำคัญคือสายตาของคุณมองไปทางนั้น
ในการวิเคราะห์ปริมาตร อุปกรณ์ที่ใช้มากที่สุดคือบิวเรตต์ เนื่องจากวิธีการนี้เกี่ยวข้องกับปฏิกิริยาเคมีและสามารถประมวลผลได้อย่างรวดเร็ว บิวเรตต์จึงยอมให้ ของเหลวจะถูกปล่อยที่ปลายเป็นหยด ซึ่งทำให้เราสามารถหยุดของเหลวไม่ให้ออกมาได้มากขึ้น ควบคุม
หนึ่งในขั้นตอนที่ใช้กันมากที่สุดในการวัดปริมาตรคือ การไทเทรต. เป็นการวิเคราะห์เชิงปริมาตรที่เกี่ยวข้องกับการเกิดปฏิกิริยาระหว่างกรดกับเบสหรือในทางกลับกัน อุปกรณ์ที่จำเป็นสำหรับการทำให้เป็นจริงนั้นแสดงไว้ในภาพด้านล่าง:
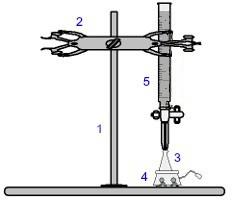
การแสดงอุปกรณ์ที่ใช้ในการไทเทรต
ตัวเลขสีน้ำเงินหมายถึง:
1) การสนับสนุนสากล
2) กรงเล็บ (เคยถือบิวเรตต์);
3) รูปชมพู่ (รับสารละลายของความเข้มข้นที่ไม่รู้จัก);
4) เครื่องกวนแม่เหล็ก (ใช้เพื่อกวนสารละลายที่มีอยู่ในขวดรูปชมพู่);
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
5) บิวเรตต์ (รับสารละลายของความเข้มข้นที่ทราบ)
ปริมาตรของสารละลายที่ไม่ทราบความเข้มข้นด้วยตัวบ่งชี้ฟีนอฟทาลีนจะถูกเติมลงในขวดรูปกรวยขวด (สารละลายจะเปลี่ยนเป็นสีชมพูในทันที) ในบิวเรตต์ จะมีการใส่ปริมาตรของสารละลายที่มีความเข้มข้นที่ทราบแล้ว จากนั้น สารละลายกรดจากบิวเรตต์จะหยดลงในสารละลายพื้นฐานในขวดรูปชมพู่โดยตรง หยดนี้จะคงอยู่จนกว่าสารละลายพื้นฐานจะไม่มีสี ณ จุดนั้นเราเรียกว่าจุดหักเห ซึ่งบ่งชี้ว่าเบสทั้งหมดที่มีอยู่ในสารละลายมีปฏิกิริยากับกรดอย่างสมบูรณ์
ที่จุดหักเห สารละลายจะไม่เป็นสีชมพูอีกต่อไปและไม่มีสี
การสังเกต: หากสารละลายไม่ทราบความเข้มข้นเป็นกรด เมื่อได้รับตัวบ่งชี้ฟีนอฟทาลีน จะไม่มีสี ดังนั้น จุดหักเหในการไทเทรตจะเกิดขึ้นเมื่อสารละลายที่เป็นกรดเปลี่ยนเป็นสีชมพูเมื่อได้รับสารละลายพื้นฐานจากบิวเรตต์
สุดท้าย ในการหาความเข้มข้นของสารละลายพื้นฐาน เพียงใช้สมการต่อไปนี้:
Ma.Va = Mb.Vb
Ma = กรดโมลาริตี;
Va = ปริมาณกรด;
Mb = โมลาริตีฐาน;
Vb = ปริมาตรฐาน
ตอนนี้ ให้ทำตามตัวอย่างวิธีการคำนวณสารละลายที่มีโมลาริตีที่ไม่รู้จัก
ครั้งที่ 1) 30 มล. ของสารละลายเบสที่ไม่รู้จักถูกเติมไปยังขวดรูปชมพู่เพื่อทำการไทเทรตเพื่อกำหนดหาความเข้มข้น (โมลาริตี) สารละลายกรด 50 มล. ถูกเติมเข้าไปในบิวเรตต์ที่มีความเข้มข้น 0.2 โมล/ลิตร หลังจากหยดสารละลายกรดและจนกระทั่งสารละลายพื้นฐานได้รับการไทเทรต พบว่ามีการใช้สารละลายกรด 20 มล. ในการไทเทรต กำหนดโมลาริตีของสารละลายพื้นฐานที่ใช้
ข้อมูลการออกกำลังกาย:
Vb = 30 มล.
เมกะไบต์ = ?
Ma = 0.2 โมล/ลิตร
Va = 20 มล.
เนื่องจากโมลาริตีของกรดและปริมาตรของกรดคือ 0.2 โมลต่อลิตรและ 20 มล. ตามลำดับ และปริมาตรของเบสที่ใช้คือ 30 มล. เพียงแค่ใช้สูตรการไทเทรต:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0.133 โมล/ลิตร
By Me. Diogo Lopes Dias
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
DAYS ดิโอโก้ โลเปส "การวิเคราะห์ปริมาตรหรือปริมาตร"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.