THE สมการ clapeyron เป็นนิพจน์ทางคณิตศาสตร์ที่เกี่ยวข้องกับปริมาณเช่น ความดัน (P) ปริมาตร (V) อุณหภูมิ (T) และจำนวนอนุภาค (n) ที่ประกอบเป็น ก๊าซที่สมบูรณ์แบบหรืออุดมคติ. สมการนี้ตั้งชื่อตามนักฟิสิกส์ชาวฝรั่งเศส พอลเอมิลclapeyron และสามารถเข้าใจได้ว่าเป็นลักษณะทั่วไปของกฎเชิงประจักษ์ของ ก๊าซสมบูรณ์แบบในเกย์-ลุสแซก, ชาร์ลส์และบอยล์ เป็นพื้นฐานสำหรับการศึกษาก๊าซในอุดมคติและทำให้เกิดวิวัฒนาการของ เครื่องทำความร้อนทำให้มีประสิทธิภาพมากขึ้นในช่วงสองสามทศวรรษที่ผ่านมา
ดูด้วย: การค้นพบทางฟิสิกส์ที่เกิดขึ้นโดยอุบัติเหตุ
สมการ Clapeyron: กฎของแก๊สในอุดมคติ
สมการของ Clapeyron คือ มาจากกฎเชิงประจักษ์สามประการก็คือกฎเกณฑ์ที่ได้มาจากการทดลอง. กฎหมายดังกล่าวอธิบายพฤติกรรมของก๊าซใน การแปลงก๊าซisovolumetric (กฎหมายเกย์-ลูสแซก) isobaric (ชาร์ลส์ ลอว์) และ ไอโซเทอร์ม (กฎของบอยล์). ตามกฎหมายเหล่านี้:
ในการเปลี่ยนแปลง isovolumetricอัตราส่วนระหว่างความดันและอุณหภูมิทางอุณหพลศาสตร์ของก๊าซในอุดมคติยังคงที่
ในการเปลี่ยนแปลง ไอโซบาริก, อัตราส่วนระหว่างปริมาตรและอุณหภูมิทางอุณหพลศาสตร์ของก๊าซในอุดมคตินั้นคงที่
- ในการเปลี่ยนแปลง ไอโซเทอร์มผลคูณของความดันและปริมาตรของก๊าซในอุดมคติยังคงที่
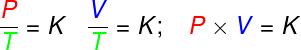
พี – ความดัน (Pa – Pascal)
วี – ปริมาณก๊าซ (m³)
ตู่ – อุณหภูมิก๊าซเทอร์โมไดนามิกส์ (K – เคลวิน)
จากกฎสามข้อข้างต้น สมการ Clapeyron เป็นตัวกำหนดมูลค่าของสิ่งนี้ ค่าคงที่ (K) ที่ได้รับในแต่ละการเปลี่ยนแปลงดังกล่าว จากสมการของ Clapeyron ค่าคงที่นี้เท่ากับจำนวนโมลคูณด้วย a ค่าคงที่ Rเรียกว่าค่าคงที่สากลของก๊าซในอุดมคติและเท่ากับ ค่าคงที่ Boltzmann คูณด้วย เบอร์ของอโวกาโดร.
สูตร
ตรวจสอบสูตรที่เรียกว่า สมการในเคปเปรอน:
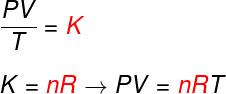
ไม่ – จำนวนโมล (โมล)
R – ค่าคงที่สากลของก๊าซในอุดมคติ (R = 0.082 atm.l/mol. K หรือ 8.314 J.mol/K)
การวิเคราะห์สมการ Clapeyron จะเห็นได้ว่า ความดัน ที่กระทำโดยก๊าซในอุดมคติคือ สัดส่วนโดยตรงกับอุณหภูมิ และยัง จำนวนโมล. นอกจากนี้ ความดันแปรผกผันกับปริมาตร ถูกครอบครองโดยก๊าซ
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
โอ แบบจำลองก๊าซในอุดมคติ ทำให้เป็นไปได้โดยสมการ Clapeyron ที่ใช้กันอย่างแพร่หลายสำหรับ การพัฒนาเครื่องจักรที่ขับเคลื่อนโดย ของเหลวเช่น เครื่องจักรที่ใช้ไอน้ำและเครื่องยนต์สันดาปภายใน
ผลลัพธ์ที่สำคัญหลายประการสามารถหาได้จากสมการ Clapeyron ตัวอย่างเช่น หนึ่งในนั้นทำนายว่า 1 โมลของก๊าซในอุดมคติใดๆ จะมีปริมาตรเท่ากับ 22.4 ลิตร เมื่ออยู่ภายใต้แรงกดดันของ 1 ตู้เอทีเอ็ม (1,01.105 Pa) และที่อุณหภูมิ 273K (0°ซ).
ดูด้วย: แนวคิดที่สำคัญที่สุดในความร้อนวิทยา
แก้ไขแบบฝึกหัดในสมการ Clapeyron
คำถามที่ 1 —(UECE) ก๊าซที่สามารถมีอุณหภูมิ ปริมาตร และความดันที่เกี่ยวข้องกับ PV = nRT มีลักษณะดังต่อไปนี้:
ก) ระยะห่างเฉลี่ยระหว่างโมเลกุลที่กว้างมาก เพื่อที่จะไม่สนใจปฏิสัมพันธ์ระหว่างโมเลกุล ยกเว้นเมื่อเกิดการชนกัน โมเลกุลเกิดการชนกันแบบยืดหยุ่น
b) ระยะห่างเฉลี่ยระหว่างโมเลกุลน้อยมาก โมเลกุลเกิดการชนกันอย่างไม่ยืดหยุ่น
c) ระยะห่างเฉลี่ยระหว่างโมเลกุลที่กว้างมาก เพื่อที่จะไม่สนใจปฏิสัมพันธ์ระหว่างโมเลกุล ยกเว้นเมื่อชนกัน โมเลกุลเกิดการชนกันอย่างไม่ยืดหยุ่น
d) ระยะห่างเฉลี่ยระหว่างโมเลกุลและปฏิกิริยาระหว่างโมเลกุลที่รุนแรงมาก โมเลกุลเกิดการชนกันแบบยืดหยุ่น
ความละเอียด:
ในแบบจำลองก๊าซในอุดมคติ อนุภาคไร้มิติจำนวนมากเคลื่อนที่ด้วยความเร็วสูงในทิศทางแบบสุ่ม ปฏิสัมพันธ์เพียงอย่างเดียวที่ได้รับจากอนุภาคเหล่านี้คือการชนกันที่ยืดหยุ่นอย่างสมบูรณ์ ดังนั้นทางเลือกที่ถูกต้องคือ จดหมาย.
คำถามที่ 2 —(UFRGS) พิจารณาข้อความต่อไปนี้เกี่ยวกับก๊าซในอุดมคติ
ผม. ค่าคงที่ R ที่มีอยู่ในสมการสถานะสำหรับก๊าซ pV = nRT มีค่าเท่ากันสำหรับก๊าซในอุดมคติทั้งหมด
ครั้งที่สอง ปริมาตรของก๊าซในอุดมคติต่างกันที่อุณหภูมิและความดันเท่ากันมีจำนวนโมเลกุลเท่ากัน
สาม. พลังงานจลน์เฉลี่ยของโมเลกุลของก๊าซในอุดมคตินั้นแปรผันตรงกับอุณหภูมิสัมบูรณ์ของแก๊ส
อันไหนถูกต้อง?
ก) ฉันเท่านั้น
b) เฉพาะII
ค) เฉพาะ III
ง) เฉพาะ I และ II
จ) I, II และ III
แม่แบบ:
ลองดูทางเลือกอื่น:
ผม. แก้ไข, ดังนั้นจึงเรียกว่าค่าคงที่สากลของก๊าซในอุดมคติ
ครั้งที่สอง แก้ไข. ตามสมการของ Clapeyron หากก๊าซในอุดมคติสองตัวมีความดัน อุณหภูมิ และปริมาตรเท่ากัน จำนวนอนุภาคในก๊าซเหล่านั้นจะเท่ากัน
สาม. แก้ไข. ตามทฤษฎีบทความเท่าเทียมกันของพลังงาน พลังงานจลน์ของอนุภาคในก๊าซในอุดมคตินั้นแปรผันตามอุณหภูมิของมัน
ดังนั้น ทางเลือกที่ถูกต้องคือ จดหมาย e.
คำถามที่ 3 — (UFJF) ผู้ชายอย่าง Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls และอื่น ๆ ได้พัฒนาการศึกษาที่สำคัญเกี่ยวกับคุณสมบัติของก๊าซ พฤติกรรมของก๊าซจริงจะใกล้เคียงกับก๊าซในอุดมคติในสภาวะความดันต่ำ เช่นเดียวกับก๊าซที่บรรจุอยู่ในปริมาตรมากและก๊าซที่กักเก็บไว้ที่อุณหภูมิสูง ให้พิจารณาว่าในการทดลองในห้องปฏิบัติการ ภาชนะที่มีปริมาตร V ถูกปิดจนสนิทและมีก๊าซในอุดมคติ 1 โมลภายใต้ความดัน 4.0 atm อยู่ภายใต้การขยายตัวที่อุณหภูมิคงที่เท่ากับ 127 º C และพฤติกรรมของก๊าซนี้เป็นของก๊าซในอุดมคติ ดังแสดงใน กราฟิก
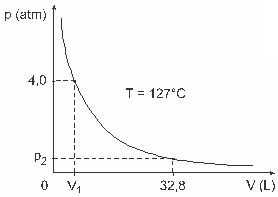
ในกรณีนี้ เมื่อก๊าซมีปริมาตรเท่ากับ 32.8 ลิตร ความดันที่กระทำโดยแก๊สจะเป็น:
(กำหนด: ค่าคงที่สากลของก๊าซสมบูรณ์คือ R = 0.082 atm ลิตร/โมล ก.)
ก) 0.32 atm
ข) 0.40 atm
ค) 1.0 atm
ง) 2.0 atm
จ) 2.6 atm
ความละเอียด:
จดหมาย ค.
ในการแก้แบบฝึกหัด เราต้องใช้ข้อมูลกับสมการ Clapeyron แต่ก่อนหน้านั้นเราต้องแปลงอุณหภูมิซึ่งอยู่ในหน่วยองศาเซลเซียสเป็นเคลวิน เช็คเอาท์:

โดย Rafael Hellerbock
ครูฟิสิกส์