เอนไซม์ เป็นตัวเร่งปฏิกิริยาทางชีวภาพที่รับผิดชอบในการเพิ่มความเร็วของปฏิกิริยาเคมีที่กำหนด เอนไซม์มักจะ โปรตีนแต่ก็มีบ้าง กรดไรโบนิวคลีอิก ซึ่งทำหน้าที่เป็นเอนไซม์ เรียกว่า ไรโบไซม์
เพื่อเร่งปฏิกิริยา เอ็นไซม์ต้องจับกับรีเอเจนต์ ซึ่งเรียกว่าซับสเตรต เชื่อกันว่าลิงก์นี้เกิดขึ้นอย่างเข้มงวดเป็นเวลานาน รูปแบบที่เรียกว่ากุญแจล็อค ในตอนนี้, อย่างไรก็ตาม, ยอมรับแบบจำลองที่เรียกว่าการเหนี่ยวนำให้เกิดความเหมาะสมซึ่งถือว่าการเปลี่ยนแปลงเล็กน้อยเกิดขึ้นในรูปแบบของเอนไซม์เมื่อซับสเตรตเข้าสู่ไซต์แอคทีฟ
อ่านด้วย: เมแทบอลิซึมคืออะไร?
เอนไซม์คืออะไร?
เอ็นไซม์เป็นชีวโมเลกุลที่ทำหน้าที่เป็นตัวเร่งปฏิกิริยา กล่าวคือ พวกมันคือ สารที่สามารถเร่งความเร็วของ ปฏิกริยาเคมี ที่เกิดขึ้นในสิ่งมีชีวิตโดยไม่ถูกบริโภคระหว่างปฏิกิริยาเหล่านี้ หากไม่มีการทำงานของเอนไซม์ ปฏิกิริยาบางอย่างจะช้ามาก ซึ่งจะเป็นอันตรายต่อการเผาผลาญ เอ็นไซม์จะเร่งปฏิกิริยาแบบคัดเลือกและเป็นตัวเร่งปฏิกิริยาที่เฉพาะเจาะจงมาก
เอ็นไซม์สามารถเร่งปฏิกิริยาโดยการลดพลังงานกระตุ้น กล่าวคือ ลดปริมาณพลังงานที่ต้องเติมเพื่อให้ปฏิกิริยาเริ่มต้น
[publication_omnia]
เอนไซม์ทุกตัวเป็นโปรตีนหรือไม่?
แม้ว่าพวกมันมักจะถูกกำหนดให้เป็นตัวเร่งปฏิกิริยาทางชีวภาพของธรรมชาติของโปรตีน ไม่ใช่ทุกเอนไซม์ที่เป็นโปรตีน มี RNA บางตัวที่ทำงานเหมือนเอนไซม์ที่เรียกว่าไรโบไซม์ อย่างไรก็ตาม เอ็นไซม์ส่วนใหญ่เป็นโปรตีน จึงถูกสร้างขึ้นโดย กรดอะมิโน. องค์ประกอบของกรดอะมิโนของชีวโมเลกุลเหล่านี้กำหนดโครงสร้างสามมิติที่มันจะได้รับ
อ่านด้วย: สารเร่งปฏิกิริยาทำงานอย่างไร
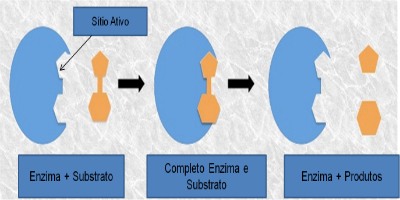
คอมเพล็กซ์เอนไซม์ - สารตั้งต้น
เรียกว่าสารตั้งต้นของตัวทำปฏิกิริยาซึ่งเอนไซม์ทำหน้าที่ เมื่อเอ็นไซม์จับกับซับสเตรต สารเชิงซ้อนจะก่อตัวขึ้น เอนไซม์-สารตั้งต้น การเชื่อมโยงนี้เกิดขึ้นในพื้นที่เฉพาะ เรียกว่าไซต์ที่ใช้งานอยู่
เมื่อเราพูดถึงเอนไซม์ที่มีโปรตีนเป็นส่วนประกอบหลัก แอกทีฟไซต์นั้นสอดคล้องกับกรดอะมิโนเพียงไม่กี่ตัว โดยส่วนที่เหลือของโมเลกุลมีหน้าที่ในการกำหนดคอนฟิกูเรชันของแอคทีฟไซต์ รูปร่างของแอคทีฟไซต์และรูปร่างของซับสเตรตนั้นสัมพันธ์กับความจำเพาะของเอ็นไซม์ เนื่องจากจะต้องเป็นส่วนเสริม
รุ่นกุญแจล็อค
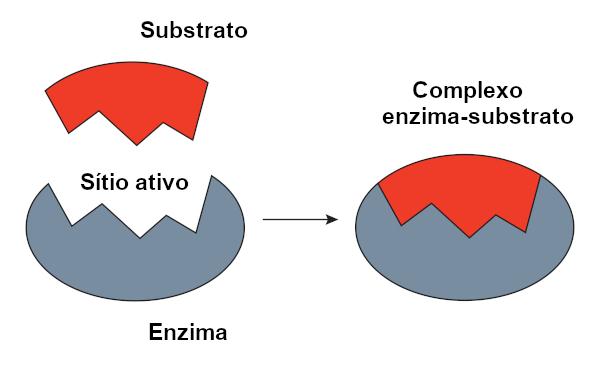
โอ รุ่นแม่กุญแจซึ่งนำเสนอโดย Emil Fischer มีการใช้กันอย่างแพร่หลายเพื่ออธิบายปฏิสัมพันธ์ระหว่างเอนไซม์กับสารตั้งต้น ตามแบบจำลองนี้ มีความสอดคล้องกันระหว่างเอ็นไซม์กับซับสเตรต เช่นเดียวกับกุญแจและตัวล็อค แอกทีฟไซต์ของเอนไซม์จะมีรูปร่างที่สมส่วนกับซับสเตรต ซึ่งจะพอดีอย่างสมบูรณ์ ดังนั้นโมเลกุลอื่นจึงไม่สามารถเข้าถึงไซต์นี้ได้ ซึ่งจะรับประกันความจำเพาะของเอนไซม์ เอ็นไซม์ก็จะจับกับซับสเตรตเช่นเดียวกับที่กุญแจเปิดได้เพียงตัวล็อค อย่างไรก็ตาม วันนี้เรารู้แล้วว่าสิ่งนี้ รุ่นไม่ถูกต้องเนื่องจากเอ็นไซม์ไม่ใช่โครงสร้างที่แข็งกระด้างอย่างที่คิดไว้ก่อนหน้านี้
โมเดลฟิตติ้งเหนี่ยวนำ
ปัจจุบัน แบบจำลองที่ได้รับการยอมรับมากที่สุดเพื่ออธิบายความเชื่อมโยงระหว่างเอนไซม์กับซับสเตรต เป็นหนึ่งใน snap ชักนำเสนอครั้งแรกโดย Koshland et al แอกทีฟไซต์และซับสเตรตไม่ทำงานเหมือนกุญแจและตัวล็อค การวิจัยแสดงให้เห็นว่าเมื่อซับสเตรตเข้าสู่ไซต์แอคทีฟ เอ็นไซม์จะผ่านการดัดแปลงเล็กน้อย ซึ่งชอบความพอดีระหว่างไซต์แอคทีฟกับซับสเตรต เพื่อให้เข้าใจโมเดลนี้มากขึ้น เราสามารถนึกถึงปฏิกิริยาระหว่างเอนไซม์และซับสเตรตเสมือนการจับมือกัน ซึ่งจะกระชับขึ้นหลังจากสัมผัสครั้งแรก
ปัจจัยร่วม
เอนไซม์ส่วนใหญ่ต้องการโมเลกุลเสริมเพื่อดำเนินการเร่งปฏิกิริยาที่เรียกว่าโคแฟคเตอร์ โคแฟคเตอร์สามารถยึดติดกับเอ็นไซม์อย่างถาวรหรือสามารถยึดติดกับซับสเตรตแบบอ่อนและกลับด้านได้ พวกเขาด้วย สามารถเป็นอนินทรีย์หรืออินทรีย์ได้. เมื่อโคแฟกเตอร์เป็นโมเลกุลอินทรีย์จะเรียกว่า โคเอ็นไซม์.
บาง วิตามิน ทำหน้าที่เป็นโคเอ็นไซม์ เช่น ไรโบฟลาวิน หรือที่เรียกว่าวิตามินบี 2 ตัวอย่างของโคแฟกเตอร์อนินทรีย์ เราสามารถพูดถึงธาตุเหล็กและสังกะสีในรูปแบบไอออนิกได้
อ่านด้วย: วิตามิน B-complex — กลุ่มของวิตามินที่โดยทั่วไปทำหน้าที่เป็นโคเอ็นไซม์
การจำแนกเอนไซม์
เอ็นไซม์สามารถจำแนกได้เป็น หกกลุ่มโดยใช้เป็นเกณฑ์ประเภทของปฏิกิริยาที่พวกมันกระตุ้น
ออกซิโดรีดักเตส: เอนไซม์ที่เกี่ยวข้องกับปฏิกิริยาของ ออกซีร์ลด.
โอน: เร่งการถ่ายโอนกลุ่มจากสารประกอบหนึ่งไปยังอีกสารหนึ่ง
ไฮโดรเลส: เร่งปฏิกิริยาไฮโดรไลซิส
นามแฝง: กระทำโดยการเพิ่มกลุ่มในพันธะคู่หรือนำกลุ่มที่ก่อตัวเป็นพันธะคู่ออก
ไอโซเมอเรส: เร่งปฏิกิริยาไอโซเมอไรเซชัน
ลิงค์: เอนไซม์ที่ทำให้โมเลกุลของ ATPโดยใช้พลังงานที่ปล่อยออกมาในปฏิกิริยานี้เพื่อสร้างสารประกอบใหม่
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
ปัจจัยที่ควบคุมการทำงานของเอนไซม์
กิจกรรมของเอนไซม์ได้รับอิทธิพลจากปัจจัยต่างๆ ปัจจัยหลักคืออุณหภูมิและ pH. อุณหภูมิโดยทั่วไปมีบทบาทเชิงบวกในปฏิกิริยาเคมี ซึ่งเพิ่มอัตราการเกิดปฏิกิริยาของเอนไซม์ อย่างไรก็ตาม เมื่อ อุณหภูมิ เพิ่มขึ้นเหนือสภาวะที่เหมาะสม ความเร็วปฏิกิริยาลดลงอย่างมาก นี่เป็นเพราะสังเกตการเสื่อมสภาพของโปรตีน เอนไซม์ของมนุษย์ส่วนใหญ่มีอุณหภูมิที่เหมาะสมระหว่าง 35 ถึง 40 ºC นอกจากอุณหภูมิแล้ว pH มันยังมีอิทธิพลต่อการทำงานของเอนไซม์ และยังมีค่าที่เหมาะสมอีกด้วย สำหรับเอนไซม์ส่วนใหญ่ ค่า pH ที่เหมาะสมจะอยู่ในช่วง 6 ถึง 8
โดย Vanessa Sardinha dos Santos
ครูชีววิทยา