ที่ แรงระหว่างโมเลกุล,เรียกทั่วไปว่า กองกำลังแวนเดอร์วาลส์มีสาม: ไดโพลเหนี่ยวนำให้เกิดไดโพล พันธะไฮโดรเจน และไดโพลถาวรแบบไดโพลถาวร ในข้อนี้ เราจะพิจารณาเฉพาะพลังสามประการสุดท้ายนี้เท่านั้น:
พลัง ไดโพลถาวร-ไดโพลถาวรหรือเพียงแค่ ไดโพล-ไดโพล เกิดขึ้นเฉพาะใน โมเลกุลขั้วนั่นคือที่ไม่มีการกระจายโหลดสม่ำเสมอตามพื้นผิว ตัวอย่างเช่น ในโมเลกุลของ HCl (ก๊าซไฮโดรคลอริก) เมฆอิเล็กทรอนิกส์จะเคลื่อนที่เข้าหาอะตอมของคลอรีนมากกว่า เนื่องจากมีอิเลคโตรเนกาติตีมากกว่าไฮโดรเจน
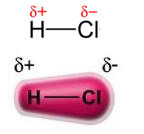
สังเกตว่ารอบๆ อะตอมของคลอรีนมีการสะสมของอิเล็กตรอนซึ่งทำให้เกิดการก่อตัวของ a ขั้วลบซึ่งเป็นสัญลักษณ์ของอักษรกรีก delta (-δ). ส่งผลให้บริเวณรอบอะตอมไฮโดรเจน a ขั้วบวก (+δ), เนื่องจากมีความหนาแน่นทางอิเล็กทรอนิกส์ต่ำ โมเลกุล HCl จะประกอบเป็น ขั้วไฟฟ้า และดังนั้น เมื่อสัมผัสกับโมเลกุล HCl อื่นที่อยู่ใกล้เคียง จะมีแรงดึงดูดระหว่างขั้วตรงข้ามของโมเลกุลดังที่แสดงด้านล่าง:
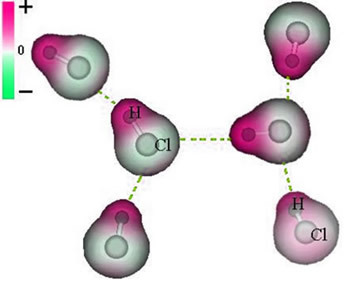
แรงดึงดูดนี้ ซึ่งกำหนดขึ้นระหว่างปลายขั้วลบของไดโพลของโมเลกุลหนึ่งกับปลายขั้วบวกของไดโพลของอีกโมเลกุลหนึ่ง ประกอบเป็นแรงไดโพล-ไดโพล.
ดังที่ชื่อบอกไว้ ไดโพลเป็นแบบถาวร จึงเกิดเฉพาะในสารประกอบมีขั้วเท่านั้น และยิ่งมีขั้วของโมเลกุลสูงเท่าใด ปฏิกิริยาไดโพลกับไดโพลก็จะยิ่งเข้มข้นขึ้นในสาร
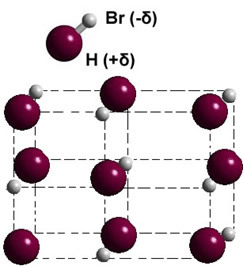
หากอยู่ในสถานะของแข็ง การก่อตัวของไดโพลถาวรจะนำทางตำแหน่งของแต่ละโมเลกุลในอวกาศ ผลึกขั้ว; ดังในกรณีของไฮโดรเจนโบรไมด์ที่แสดงไว้ด้านล่าง:
ตัวอย่างอื่นๆ ของสารที่มีขั้วที่มีความแรงของไดโพล-ไดโพลระหว่างโมเลกุล ได้แก่ H2S, CO, HCCl3, เท่านั้น2.
แรงระหว่างโมเลกุลนี้เป็นของ ความเข้มปานกลางเนื่องจากแรงดึงดูดของไดโพลที่เกิดจากไดโพลจะแรงกว่า แต่มีความเข้มข้นน้อยกว่าพันธะไฮโดรเจน นี่คือสาเหตุที่จุดหลอมเหลวและจุดเดือดของพวกมันสูงกว่าสารที่มีความแรงไดโพลเหนี่ยวนำ เนื่องจากแรงไดโพลถาวรแข็งแกร่งขึ้น จึงจำเป็นต้องจัดหาพลังงานมากขึ้นเพื่อให้ปฏิกิริยาของโมเลกุลแตกตัว
โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm
