กัมมันตภาพรังสี เป็นสมบัติที่อะตอมบางตัวเช่น ยูเรเนียม และ วิทยุ, ต้องออกให้เอง พลังงาน ในรูปของ อนุภาค และ คลื่น, กลายเป็น องค์ประกอบทางเคมี มีเสถียรภาพมากขึ้นและเบาขึ้น
ประเภท
กัมมันตภาพรังสีแสดงตัวด้วย สองทาง การแผ่รังสีต่างๆ: อนุภาค — อัลฟา (α) และเบต้า (β); และคลื่นแม่เหล็กไฟฟ้า — รังสีแกมมา (γ).
แอลฟา: เป็นอนุภาคบวกที่ประกอบด้วยโปรตอนสองตัวและนิวตรอน 2 ตัว และมีกำลังการแทรกซึมต่ำ
บีตา: เป็นอนุภาคลบที่ไม่มีมวลซึ่งประกอบด้วยอิเล็กตรอน (มวลเล็กน้อย) และพลังการแทรกซึมของพวกมันมากกว่ารังสีอัลฟา แต่น้อยกว่ารังสีแกมมา
แกมมา: เป็นคลื่นแม่เหล็กไฟฟ้าพลังงานสูง และเนื่องจากไม่ใช่อนุภาค จึงไม่มีมวล
อ่านด้วยนะ: สูตรกัมมันตภาพรังสี
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
กฎหมาย
การปล่อยอนุภาคกัมมันตภาพรังสีเป็นไปตามพฤติกรรมบางอย่างที่อธิบายโดยกฎของ กัมมันตภาพรังสี (หนึ่งอันสำหรับอนุภาคอัลฟาและอีกอันสำหรับอนุภาคบีตา) ซึ่งนักเคมีอธิบายไว้ ภาษาอังกฤษ เฟรเดอริค ซอดดี้และโดยนักเคมีและนักฟิสิกส์ชาวโปแลนด์ คาซิเมียร์ซ ฟายานส์.
กฎข้อที่หนึ่งของกัมมันตภาพรังสี
ตามกฎข้อนี้ เมื่ออะตอมกัมมันตภาพรังสีแผ่รังสีชนิดแอลฟาออกมา จะทำให้เกิด a
อะตอมใหม่ ด้วยแกนที่ประกอบด้วย โปรตอนสองตัว และ สองนิวตรอน น้อยกว่า รวมเป็นมวล เล็กกว่าสี่หน่วย. เราสามารถแสดงกฎข้อที่หนึ่งของกัมมันตภาพรังสีด้วยสมการทั่วไปต่อไปนี้: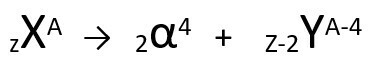
สมการทั่วไปของกฎข้อที่หนึ่งของกัมมันตภาพรังสี
ลองดูตัวอย่าง:
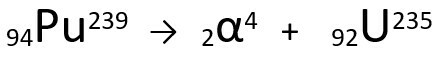
สมการที่แทนการปลดปล่อยอนุภาค α โดยพลูโทเนียม-239
โปรดทราบว่าเมื่อปล่อยรังสีอัลฟา อะตอมที่ก่อตัวขึ้นใหม่ ยูเรเนียม-235 มีเลขมวลสี่หน่วยที่เล็กกว่าและ เลขอะตอมน้อยกว่าสองหน่วย - ค่าที่สอดคล้องกับอนุภาคαที่ปล่อยออกมาจากนิวเคลียสของ พลูโทเนียม หากต้องการเรียนรู้เพิ่มเติม ไปที่: กฎข้อที่หนึ่งของกัมมันตภาพรังสีหรือกฎของโซดาที่หนึ่ง.
กฎข้อที่สองของกัมมันตภาพรังสี
กฎข้อที่สองพูดถึง ปัญหาเบต้า. เมื่ออะตอมปล่อยอนุภาคบีตา ซึ่งประกอบด้วยอิเล็กตรอนและมีมวลเล็กน้อย, มวลอะตอม ซาก ไม่เปลี่ยนแปลง มันเป็นของคุณ เลขอะตอมเพิ่มขึ้นหนึ่งหน่วย. โดยทั่วไปเราเป็นตัวแทนดังต่อไปนี้:
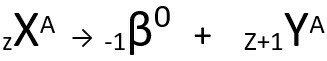
สมการทั่วไปของกฎข้อที่สองของกัมมันตภาพรังสี
ดูตัวอย่าง:
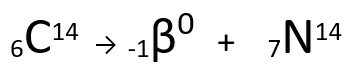
สมการที่แสดงถึงการปล่อยอนุภาคβโดย Carbon-14
จะเห็นได้ว่าอะตอมของไนโตรเจนที่ก่อตัวขึ้นนั้นมีมวลเท่ากับอะตอม C-14 กล่าวคือ ไอโซบาร์และเลขอะตอมของมันเพิ่มขึ้นหนึ่งหน่วย เพิ่มขึ้นใน เลขอะตอมถูกอธิบายโดยนักวิทยาศาสตร์ Henrico Fermiซึ่งเสนอว่าหนึ่งใน นิวตรอน ของนิวเคลียสได้รับการแปลงร่างตามสมการต่อไปนี้ ทำให้เกิด อิเล็กตรอน(อนุภาคบีตาที่ปล่อยออกมา) นิวตริโน(อนุภาคย่อยของอะตอมที่ไม่มีประจุไฟฟ้าและไม่มีมวล ) และ โปรตอน(ป).
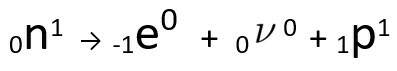
สมการแทนการแปลงนิวตรอนตามสมมติฐานของ Fermi
โอ อิเล็กตรอน มันเป็น นิวตริโน ออกให้แก่ ออกจากแกน, เหลือ เท่านั้น โปรตอนซึ่งอธิบายการเพิ่มขึ้นของเลขอะตอม หากต้องการเรียนรู้เพิ่มเติม ไปที่: กฎข้อที่สองของกัมมันตภาพรังสีหรือกฎข้อที่สองของโซดา.
อ่านด้วย: ความแตกต่างระหว่างการปนเปื้อนกัมมันตภาพรังสีและการฉายรังสี
แอปพลิเคชั่น
ทั้งๆ ที่ มุมมองเชิงลบ ที่สะสมกัมมันตภาพรังสีก็มี แอปพลิเคชันที่สำคัญ ในชีวิตประจำวันของเรา เช่น ใน ผลผลิตของ ไฟฟ้าใน โรงไฟฟ้านิวเคลียร์ ผ่าน ฟิชชันของอะตอมกัมมันตภาพรังสี
ปัจจุบันบราซิลไม่ได้ใช้ the พลังงานนิวเคลียร์ เป็นแหล่งพลังงานหลัก แต่มีโรงไฟฟ้านิวเคลียร์ (อังกรา 1 และ 2) ที่ทำงานเพื่อจ่ายกระแสไฟฟ้าให้กับประเทศ นอกจากนี้เรายังสามารถพูดถึง การออกเดทของวัสดุ ค้นพบโดยนักโบราณคดีใช้ คาร์บอน-14.

โรงไฟฟ้านิวเคลียร์รีโอเดจาเนโร บราซิล
บทบาทพื้นฐานอีกประการหนึ่งที่กัมมันตภาพรังสีเกี่ยวข้องกับสาขาการแพทย์เช่นใน เอ็กซ์เรย์และใน CT สแกนและในบางประเภทของ การรักษามะเร็ง.
อ่านด้วยนะ: ความเสี่ยงหลักของการผลิตพลังงานนิวเคลียร์เพื่อสิ่งแวดล้อม
กัมมันตภาพรังสีธรรมชาติ
เราเป็นทุกวัน เปิดเผย ดิ ปริมาณน้อย ของรังสีไม่ว่าจะประดิษฐ์หรือโดยธรรมชาติ กัมมันตภาพรังสีตามธรรมชาติเกิดขึ้นเองตามธรรมชาติ ส่วนหนึ่งของรังสีที่เราได้รับนี้มาจากอาหารที่บริโภคในแต่ละวัน เช่น เรดอน-226 และโพแทสเซียม-40 ซึ่งแสดงอยู่ใน ระดับต่ำมาก และไม่ก่อให้เกิดความเสี่ยงต่อสุขภาพของเราหรือทำลายคุณค่าทางโภชนาการของอาหาร
กระบวนการให้อาหารปล่อยสารกัมมันตภาพรังสีนี้มีจุดมุ่งหมายเพื่อ ถนอมอาหาร และส่งเสริม a เจริญเติบโตของพืช. ตัวอย่างอาหารที่ปล่อยรังสี ได้แก่ ถั่วบราซิล, กล้วย, ถั่ว, เนื้อแดง เป็นต้น
การค้นพบ
การศึกษากัมมันตภาพรังสีเริ่มต้นด้วยการวิจัยโดยนักฟิสิกส์ชาวเยอรมัน วิลเฮล์ม เรินต์เกนเมื่อปี พ.ศ. 2438 ขณะทรงสอบสวน ผลกระทบของเรืองแสง. นักวิทยาศาสตร์ที่สำคัญอีกคนหนึ่งในการพัฒนากัมมันตภาพรังสีคือนักฟิสิกส์ชาวฝรั่งเศส อองตวน-อองรี เบคเคอเรลผู้ซึ่งสังเกตเห็นในปี พ.ศ. 2439 เครื่องหมายบนฟิล์มถ่ายภาพโดยตัวอย่างเกลือยูเรเนียม
อย่างไรก็ตามมันเป็น คูรี คู่รัก ที่ใช้คำว่ากัมมันตภาพรังสีเป็นครั้งแรก ใน 1898, คนโปแลนด์ Marie Curie ศึกษาเกี่ยวกับกัมมันตภาพรังสีอย่างต่อเนื่องและค้นพบสิ่งล้ำค่าสำหรับพื้นที่ดังกล่าว เช่น การค้นพบธาตุกัมมันตภาพรังสีใหม่ 2 ชนิด ได้แก่ พอโลเนียม (Po) และเรเดียม (Ra)
ด้านหลัง เออร์เนสต์ รัทเทอร์ฟอร์ด ค้นพบรังสีอัลฟ่า (α) และเบต้า (β) ซึ่งให้คำอธิบายที่ดีขึ้นสำหรับแบบจำลองอะตอมของมัน เช่นเดียวกับความก้าวหน้าของการวิจัยที่เกี่ยวข้องกับกัมมันตภาพรังสี
อ่านด้วย:Marie Curie: ชีวประวัติผลงานและมรดก
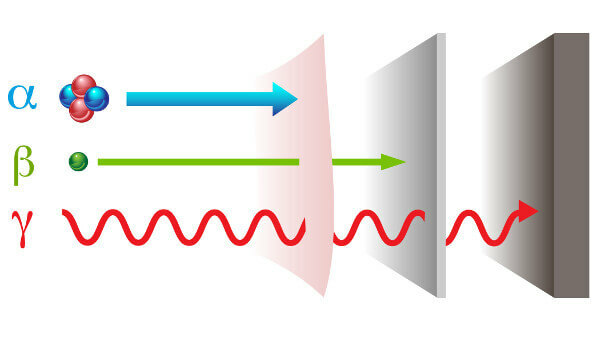
ประเภทของรังสีและพลังการแทรกซึม
ผุ
โอ การสลายตัวของสารกัมมันตรังสี (หรือการแปลงร่าง) คือ กระบวนการทางธรรมชาติ ที่ไหน แกนไม่เสถียร ปล่อยรังสี, ตามลำดับ เพื่อที่จะ ลดพลังงานลง และมั่นคงขึ้น
โดยปกติจะเกิดขึ้นกับอะตอมของเลขอะตอม มากกว่า 84ซึ่งเป็นอะตอมที่มี ความไม่แน่นอนสูง นิวเคลียร์เนื่องจากปริมาณประจุบวก (โปรตอน) ที่สะสมอยู่ในนิวเคลียส ในขั้นตอนนี้ นิวตรอนไม่เพียงพอ เพื่อทำให้โปรตอนทั้งหมดที่คลัสเตอร์อยู่ในนิวเคลียสเสถียร จากนั้นนิวเคลียสจะเริ่มสลายตัวด้วยกัมมันตภาพรังสีจนกว่าเลขอะตอมจะน้อยกว่า 84
ในบางกรณี อะตอมที่มีเลขอะตอมน้อยกว่า 84 อาจมีนิวเคลียสที่ไม่เสถียรและ ผ่านกระบวนการสลายตัว แต่ต้องมีจำนวนโปรตอนมากกว่าจำนวน นิวตรอน
การสลายตัวของกัมมันตภาพรังสีคือ คำนวณโดยครึ่งชีวิต (หรือช่วงกึ่งสลายตัว P) ของ ไอโซโทปรังสีซึ่งเป็นเวลาที่กำหนดให้มวลครึ่งหนึ่งของตัวอย่างกัมมันตภาพรังสีเริ่มต้นสลายตัว กล่าวคือ เพื่อให้เสถียร ในแง่กราฟิก แนวคิดของครึ่งชีวิตแสดงอยู่ด้านล่าง เพราะมันคือเ กระบวนการต่อเนื่อง, เส้นโค้งมีแนวโน้มที่จะถึง ศูนย์.
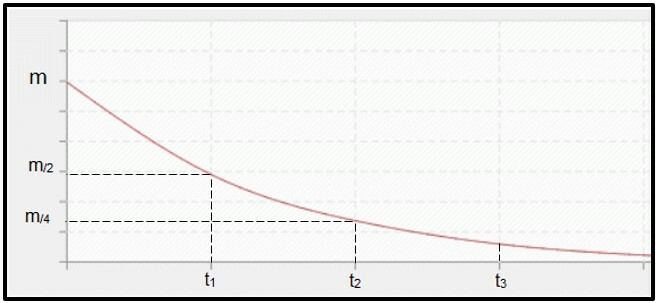
กราฟแสดงเวลาครึ่งชีวิต
การคำนวณที่เกี่ยวข้องกับการสลายตัวของกัมมันตภาพรังสีเป็นไปตามสูตรต่อไปนี้:
สูตรคำนวณมวลที่เหลือหลังครึ่งชีวิต:
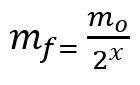
มฉ – มวลสุดท้าย
มโอ – มวลเริ่มต้น
x – จำนวนครึ่งชีวิตที่ผ่านไป
สูตรคำนวณเวลาการสลายตัวของตัวอย่างกัมมันตภาพรังสี:
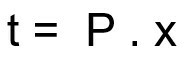
t – เวลาสลายตัว
P - ระยะครึ่งชีวิต
x – จำนวนครึ่งชีวิตที่ผ่านไป
ธาตุกัมมันตรังสี
มีสองประเภทคือ ธาตุกัมมันตรังสี: คุณ ธรรมชาติ และ เทียม. ธาตุธรรมชาติมีธาตุที่พบในธรรมชาติอยู่แล้วด้วยแกนที่ไม่เสถียร เช่น such ยูเรเนียม, O แอกทิเนียม มันเป็น วิทยุ. สิ่งที่ประดิษฐ์เกิดจากกระบวนการที่ทำให้นิวเคลียสของอะตอมไม่เสถียร ในกรณีนี้ เราสามารถพูดถึง แอสทาทีน มันเป็น แฟรนเซียม.
ธาตุกัมมันตภาพรังสีหลัก ได้แก่ ยูเรเนียม-235 โคบอลต์-60 สตรอนเทียม-90 เรเดียม-224 และไอโอดีน-131 เนื่องจากมีการใช้กันอย่างแพร่หลายในโรงไฟฟ้านิวเคลียร์และการรักษาโรคมะเร็ง องค์ประกอบเหล่านี้จึงมีแนวโน้มที่จะปรากฏบ่อยขึ้นในชีวิตประจำวันของเรา หากต้องการเรียนรู้เพิ่มเติมเกี่ยวกับเรื่องนี้ ไปที่: ธาตุกัมมันตรังสี.
ขยะกัมมันตภาพรังสี
กากกัมมันตภาพรังสีหรือ กากนิวเคลียร์ มันเป็น สารตกค้าง ของ อุตสาหกรรม ที่ใช้วัสดุกัมมันตภาพรังสีในกระบวนการที่ไม่มีการใช้งานจริงอีกต่อไป ขยะส่วนใหญ่มาจาก โรงไฟฟ้านิวเคลียร์ มาจาก โปรแกรมทางการแพทย์.
การผลิตกากกัมมันตภาพรังสีปริมาณมากได้รับ a ปัญหาสิ่งแวดล้อม แก่โลกทั้งโลกเพราะขาดแคลนและไม่เพียงพอ เงื่อนไขการกำจัด และการจัดเก็บ
หางเหล่านี้เกี่ยวข้องกับการปนเปื้อนของดิน ทางน้ำ และอากาศ ส่งผลให้ การทำลายสิ่งแวดล้อม ค่อยๆ. นอกจากนี้ยังก่อให้เกิดความเสี่ยงต่อสุขภาพของมนุษย์ เช่น การติดเชื้อ, โรคมะเร็ง และในกรณีที่เกิดการปนเปื้อนที่รุนแรงขึ้น ก็สามารถนำไปสู่ ความตาย.
แก้ไขแบบฝึกหัด
(PUC-Camp-SP) ระเบิดปรมาณูหรือที่เรียกว่าระเบิดนิวเคลียร์มีอะตอมยูเรเนียม-235 เป็นส่วนประกอบฟิชไซล์ , ตัวปล่อยอนุภาคแอลฟา
, ตัวปล่อยอนุภาคแอลฟา 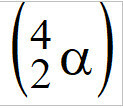 . แต่ละอะตอมของ U-235 เมื่อปล่อยอนุภาคแอลฟาออกมา จะเปลี่ยนเป็นธาตุอื่นซึ่งมีเลขอะตอมเท่ากับ
. แต่ละอะตอมของ U-235 เมื่อปล่อยอนุภาคแอลฟาออกมา จะเปลี่ยนเป็นธาตุอื่นซึ่งมีเลขอะตอมเท่ากับ
ก) 231.
ข) 233
ค) 234.
ง) 88.
จ) 90.
แม่แบบ: เมื่ออะตอมปล่อยอนุภาคแอลฟา จำนวนอะตอมจะลดลงสองหน่วย ตามกฎข้อที่หนึ่งของกัมมันตภาพรังสี ดังนั้น: 92-2 = 90 จดหมายจ.
(PUC-Camp-SP) ไอโอดีน-125 ไอโอดีนหลากหลายชนิดที่มีกัมมันตภาพรังสีพร้อมการใช้ยา มีครึ่งชีวิต 60 วัน จะมีไอโอดีน-125 เหลืออยู่กี่กรัมหลังจากหกเดือน โดยพิจารณาจากตัวอย่างที่มีไอโซโทปรังสี 2.00 กรัม
ก) 1.50
ข) 0.75
ค) 0.66
ง) 0.25
จ) 0.10
แม่แบบ: ขั้นแรก คำนวณจำนวนครึ่งชีวิตที่ผ่านไปในช่วง 180 วัน:
เสื้อ = ป. x
180 = 60. x
x = 3
เมื่อพบจำนวนครึ่งชีวิตที่ผ่านไป มวลที่จะยังคงอยู่เมื่อสิ้นสุด 180 วันจะถูกคำนวณ:
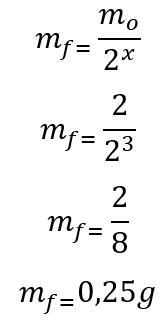
ดังนั้น 0.25g ของไอโซโทปรังสีของไอโอดีน-135 จะยังคงอยู่เมื่อสิ้นสุดหกเดือน จดหมาย ง.
โดย Victor Felix
จบเคมี