โอ การคำนวณจำนวนอนุภาคอะตอม ใช้เพื่อระบุปริมาณของโปรตอน (ในนิวเคลียส) อิเล็กตรอน (ในอิเล็กโตรสเฟียร์) และนิวตรอน (ในนิวเคลียส) ที่มีอยู่ในอะตอมหรือไอออนใดๆ ในการทำเช่นนี้ จำเป็นต้องทราบคุณลักษณะบางประการของอะตอม:
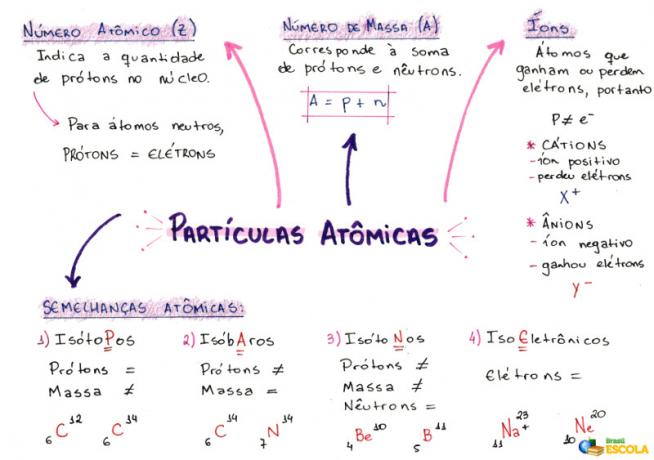
1- เลขอะตอม (Z)
เป็นรหัสทางคณิตศาสตร์ซึ่งแสดงด้วยตัวพิมพ์ใหญ่ Z ซึ่งอยู่ด้านล่างซ้ายของตัวย่อของอะตอม:
ZX
มันระบุจำนวนโปรตอน (p) ในนิวเคลียสและจำนวนอิเล็กตรอน (e) ในอิเล็กโตรสเฟียร์ของอะตอม ดังนั้น โดยทั่วไปแล้ว:
Z = p = e
2- เลขมวล (A)
เป็นรหัสทางคณิตศาสตร์ที่สอดคล้องกับผลรวมของจำนวนโปรตอน (p) และนิวตรอน (n) ซึ่งทั้งคู่มีอยู่ในนิวเคลียสของอะตอมใดๆ สมการที่แสดงจำนวนมวลนั้นกำหนดโดย:
A = p + n
เนื่องจากจำนวนโปรตอนเท่ากับเลขอะตอม เราสามารถเขียนสมการเพื่อคำนวณเลขมวลได้ดังนี้
A = Z + n
หากเราทราบเลขมวลและเลขอะตอมของอะตอม เราสามารถหาจำนวนนิวตรอนได้ดังนี้
n = A - Z
3- ไอออน
เป็นอะตอมที่สูญเสียหรือได้รับอิเล็กตรอน พวกเขามีเครื่องหมายบวกหรือลบอยู่ที่ด้านบนขวาของการเป็นตัวแทน ตามรูปแบบต่อไปนี้:
X+ หรือ X-
ไอออนบวก: สิ่งนี้เรียกว่าไอออนบวกและเครื่องหมายบวกแสดงว่าสูญเสียอิเล็กตรอน
ไอออนลบ: สิ่งนี้เรียกว่าประจุลบ และเครื่องหมายลบแสดงว่าได้รับอิเล็กตรอน
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
4- ความคล้ายคลึงของอะตอม
ก) ไอโซโทป
อะตอมที่มีเลขอะตอมและเลขมวลต่างกัน ตัวอย่าง:
7X14 และ 7Y16
อะตอม X และ Y มีเลขอะตอมเท่ากัน (ทางด้านซ้ายของตัวย่อ) นั่นคือเท่ากับ 7 Atom X มีเลขมวล (ทางด้านขวาของตัวย่อ) เท่ากับ 14 และอะตอม Y มีเลขมวลเท่ากับ 16
ข) ไอโซบาร์
อะตอมที่มีเลขมวลเท่ากันและเลขอะตอมต่างกัน ตัวอย่าง:
15X31 และ 13Y31
อะตอม X และ Y มีเลขมวล (ทางด้านขวาของตัวย่อ) เท่ากับ 31 อะตอม X มีเลขอะตอมเท่ากับ 15 และอะตอม Y มีเลขอะตอมเท่ากับ 13
ค) ไอโซโทน
อะตอมที่มีเลขมวลและเลขอะตอมต่างกัน แต่มีนิวตรอนเท่ากัน
ง) ไอโซอิเล็กทรอนิกส์
อะตอมที่มีจำนวนอิเล็กตรอนเท่ากัน ตัวอย่าง:
12X+2 และ 7Y-3
Atom X มีเลขอะตอมเท่ากับ 12 และเป็นไอออนบวก (มีประจุบวก +2) ดังนั้นจึงสูญเสียอิเล็กตรอนไป 2 ตัว จึงมีอิเล็กตรอน 10 ตัวอยู่ในอิเล็กโตรสเฟียร์ อะตอม Y มีเลขอะตอมเท่ากับ 7 และเป็นประจุลบ (มีประจุลบ -3) ดังนั้นจึงได้รับอิเล็กตรอน 3 ตัว จึงมีอิเล็กตรอน 10 ตัวในอิเล็กโตรสเฟียร์
Mind Map: อนุภาคปรมาณู
* ในการดาวน์โหลดแผนที่ความคิดในรูปแบบ PDF คลิกที่นี่!
ตัวอย่างการคำนวณจำนวนอนุภาคอะตอม
ตัวอย่างที่ 1: กำหนดจำนวนโปรตอน นิวตรอน และอิเล็กตรอนในอะตอม 14X29.
ค่าต่อไปนี้สำหรับอะตอม X ได้รับ:
เลขมวล (ขวาบน) = 29
เลขอะตอม (ล่างซ้าย) = 14
ในการกำหนดจำนวนโปรตอน:
จำนวนโปรตอนจะเท่ากับเลขอะตอมเสมอ ดังนั้นอะตอม X มี 14 โปรตอน
เพื่อกำหนดจำนวนอิเล็กตรอน:
เนื่องจากอะตอม X ไม่ใช่ไอออน จำนวนอิเล็กตรอนจึงเท่ากับจำนวนโปรตอน นั่นคือ 14
เพื่อกำหนดจำนวนนิวตรอน:
จำนวนนิวตรอนถูกกำหนดโดยใช้จำนวนของมวลและโปรตอนในสูตรต่อไปนี้:
A = p + n
29 = 14 + n
29 - 14 = น
n = 15
ตัวอย่างที่ 2: กำหนดจำนวนโปรตอน นิวตรอน และอิเล็กตรอนของไอออน X+3โดยรู้ว่าเลขมวลและเลขอะตอมของพวกมันคือ 51 และ 23 ตามลำดับ
ค่าต่อไปนี้สำหรับไอออน X ได้รับ:
มวล = 51
เลขอะตอม (ล่างซ้าย) = 23
ในการกำหนดจำนวนโปรตอน:
จำนวนโปรตอนจะเท่ากับเลขอะตอมเสมอ ดังนั้นอะตอม X มี 23 โปรตอน
เพื่อกำหนดจำนวนอิเล็กตรอน:
ไอออน X เป็นบวก (+3) ดังนั้นจึงเป็นไอออนบวกที่สูญเสียอิเล็กตรอนไปสามตัว จำนวนอิเล็กตรอนของมันคือ 20
บันทึก: จำนวนอิเล็กตรอนลดลงหรือเพิ่มขึ้นสัมพันธ์กับเลขอะตอมเสมอ
เพื่อกำหนดจำนวนนิวตรอน:
จำนวนนิวตรอนถูกกำหนดโดยใช้จำนวนของมวลและโปรตอนในสูตรต่อไปนี้:
A = p + n
51 = 23 + n
51 - 23 = น
n = 28
ตัวอย่างที่ 3: อะตอม W มีเลขอะตอมและมวลเท่ากับ 29 และ 57 ตามลำดับ โดยเป็นไอโซแบร์ของa อะตอม Y ซึ่งมีเลขอะตอมเท่ากับ 30 ซึ่งเป็นไอโซโทปของอะตอม B ซึ่งมีเลขมวลเท่ากับ 65. ด้วยข้อมูลนี้ ให้กำหนดจำนวนโปรตอน นิวตรอน และอิเล็กตรอนในอะตอม B
ข้อมูลที่จัดทำโดยแบบฝึกหัด:
อะตอม W
เลขอะตอม (ล่างซ้าย) = 29
เลขมวล (ขวาบน) = 57
Y isobar คือมวลของ Y เท่ากับ 57 ด้วย
Y อะตอม a
เลขอะตอม = 30
เลขมวล = 57
ด้วยค่าสองค่านี้ เราต้องกำหนดจำนวนนิวตรอนเพราะเป็นไอโซโทนขององค์ประกอบ B:
A = Z + n
57 = 30 + n
57 - 30 = n
n = 27
อะตอม ข:
เลขมวล = 65
จำนวนนิวตรอน = 27
ด้วยข้อมูลเหล่านี้ เราต้องกำหนดเลขอะตอมของมัน เพราะเราจะกำหนดจำนวนโปรตอนและจำนวนอิเล็กตรอน (เนื่องจากไม่ใช่ไอออน):
A = Z + n
65 = Z +27
65 - 27 = Z
Z = 38
ดังนั้นอะตอม B มี 38 โปรตอน 38 อิเล็กตรอนและ 27 นิวตรอน
* แผนที่ความคิดโดย Victor Ricardo Ferreira
ครูสอนเคมี
By Me. Diogo Lopes Dias

