พันธะไอออนิกเกิดขึ้นระหว่างไอออนตามชื่อของมัน เนื่องจากมีประจุตรงข้ามกัน ไอออนบวก (องค์ประกอบที่มีประจุบวก) และแอนไอออน (องค์ประกอบที่มีประจุลบ) จะดึงดูดกันด้วยไฟฟ้าสถิต ทำให้เกิดพันธะ อย่างไรก็ตาม ของแข็งไอออนิกประกอบด้วยการรวมตัวของไพเพอร์และแอนไอออนที่รวมตัวกันด้วยรูปทรงเรขาคณิตที่กำหนดไว้อย่างดี เรียกว่าแลตทิซหรือแลตทิซผลึก
ตัวอย่างเช่น เกลือ (โซเดียมคลอไรด์) เกิดขึ้นจากการถ่ายโอนอิเล็กตรอนจากโซเดียมไปยังคลอรีนขั้นสุดท้ายทำให้เกิดโซเดียมไอออนบวก (Na+) และคลอไรด์ไอออน (Cl-). ในทางปฏิบัติ ปฏิกิริยานี้ไม่ได้เกี่ยวข้องกับอะตอมเพียงสองอะตอมเท่านั้น แต่ยังรวมถึงอะตอมจำนวนมหาศาลและไม่ทราบแน่ชัดซึ่งก่อตัวเป็นโครงผลึกรูปลูกบาศก์ ดังที่แสดงด้านล่าง:
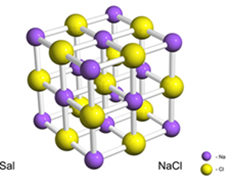
ถ้าเราดูที่ผลึกเกลือด้วยกล้องจุลทรรศน์อิเล็กตรอนแบบส่องกราด เราจะเห็นว่ามันเป็นลูกบาศก์จริงๆ เนื่องจากโครงสร้างภายในของพวกมัน

เนื่องจากสารประกอบไอออนิกทุกตัวประกอบด้วยไอออนที่ไม่แน่นอนและมีจำนวนมาก เราจะแสดงสารประกอบไอออนิกได้อย่างไร
สูตรที่มักใช้คือ สูตรหน่วยซึ่งก็คือตัวที่ แสดงถึงสัดส่วนที่แสดงโดยจำนวนไอออนบวกและแอนไอออนที่น้อยที่สุดที่เป็นไปได้ที่ประกอบเป็นผลึกขัดแตะ เพื่อให้ประจุทั้งหมดของสารประกอบเป็นกลาง
. เพื่อให้สิ่งนี้เกิดขึ้นได้ จำเป็นที่จำนวนอิเล็กตรอนที่อะตอมมอบให้ต้องเท่ากับจำนวนอิเล็กตรอนที่อะตอมอื่นได้รับลักษณะบางประการเกี่ยวกับสูตรหน่วยของสารประกอบไอออนิกมีความสำคัญ ดูบางส่วน:
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
- เขียนประจุบวกก่อนเสมอจากนั้นจึงตามด้วยประจุลบ
- เนื่องจากสารประกอบไอออนิกทุกตัวมีความเป็นกลางทางไฟฟ้า จึงไม่จำเป็นต้องเขียนประจุไอออนแต่ละตัว
- หมายเลขตัวห้อยที่ปรากฏทางด้านขวาของแต่ละไอออนระบุอัตราส่วนของอะตอมของไอออนบวกต่อประจุลบ ตัวเลขเหล่านี้เรียกว่าดัชนีและไม่ได้เขียนหมายเลข 1
ตัวอย่างเช่น ในกรณีของโซเดียมคลอไรด์ เรามีสูตรหน่วยของมันคือ NaCl เนื่องจากเรามีโซเดียมไอออนบวก 1 ตัวสำหรับแอนไอออนของคลอไรด์แต่ละตัว
ดูตัวอย่างอื่น Al3+ มีประจุบวกสามประจุ ในขณะที่ F- มีประจุลบเพียงตัวเดียว ดังนั้นจำเป็นต้องมีแอนไอออนฟลูออไรด์สามตัวเพื่อทำให้สารประกอบเป็นกลาง ดังนั้นเราจึงสรุปได้ว่าสูตรหน่วยของมันคือ AlF3.
วิธีง่ายๆ ในการหาสูตรหน่วยของสารประกอบไอออนิกคือ การแลกเปลี่ยนประจุเป็นค่าดัชนี ดังที่แสดงไว้ในวิธีทั่วไปด้านล่าง:
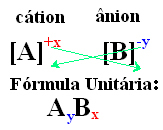
ตัวอย่าง:

อีกสูตรหนึ่งที่ใช้แทนสารไอออนิกคือ สูตรลูอิส หรือ สูตรอิเล็กทรอนิกส์, อะไร หมายถึงอิเล็กตรอนจากเปลือกความจุของไอออน "ลูก" รอบสัญลักษณ์ธาตุ ในกรณีของเกลือ เรามี:

โดย เจนนิเฟอร์ โฟกาซา
จบเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
โฟกาซ่า, เจนนิเฟอร์ โรชา วาร์กัส "สูตรสำหรับเป็นตัวแทนของพันธะไอออนิก"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm. เข้าถึงเมื่อ 28 มิถุนายน 2021.
b) กำหนดค่าของ x ในสูตรโซเดียมอะลูมิเนียมฟลูออไรด์
สารประกอบไอออนิก ลักษณะสำคัญของสารประกอบไอออนิก พันธะระหว่างไอออน การถ่ายโอนขั้นสุดท้ายของอิเล็กตรอน แรงดึงดูดของไฟฟ้าสถิตระหว่างไอออน ไอออนลบและประจุบวก แอนไอออน ไอออนบวก พันธะไอออนิก โครงสร้างโมเลกุล เขา
สูตรเชิงพื้นที่คาร์บอน, สูตรอิเล็กทรอนิกส์ลูอิส, โครงสร้างระนาบ, คู่อิเล็กทรอนิกส์, พันธะ โควาเลนต์, ชั้นเวเลนซ์, วิวัฒนาการของแบบจำลองอะตอม, สูตรโมเลกุล, สูตรโครงสร้าง, สูตร สามมิติ
สูตรเคมี สูตรโครงสร้างแบน สูตรโครงสร้างคูเปอร์ พันธะสาม แก๊ส ไนโตรเจน, สูตรอิเล็กทรอนิกส์, สูตรลิวอิส, สูตรโมเลกุล, พันธะเดี่ยว, พันธะคู่, แก๊ส คาร์บอนิก
เคมี

พันธะไอออนิก การจัดเรียงตัวระหว่างสารประกอบไอออนิก การรวมตัวของไอออนิก โซเดียมคลอไรด์ เกลือแกง สารไอออนิก แรงดึงดูดของไฟฟ้าสถิต, คลอไรด์แอนไอออน, โซเดียมไอออนบวก, ตัวทำละลายที่มีขั้ว, ไอออนบวก, ไอออนบวก, ไอออนลบ, แอนไอออน



