แนวคิดของกระบวนการที่ย้อนกลับได้และไม่สามารถย้อนกลับได้สามารถอธิบายได้ทางคณิตศาสตร์โดยใช้แนวคิดของเอนโทรปี แต่ก่อนที่เราจะไปถึงคำจำกัดความของเอนโทรปี มาดูแนวคิดของกระบวนการที่ย้อนกลับได้และไม่สามารถย้อนกลับได้ เราเรียก กระบวนการย้อนกลับ ซึ่งระบบสามารถกลับสู่สถานการณ์เดิม (หรือสถานะ) ได้เองตามธรรมชาติ กระบวนการที่ไม่สามารถย้อนกลับได้ เป็นระบบที่ระบบไม่สามารถกลับสู่สภาพเดิมได้เองตามธรรมชาติ
ตามที่ได้กล่าวถึงแนวคิดของประเภทของกระบวนการแล้ว ไปที่คำจำกัดความของเอนโทรปี THE เอนโทรปี ของระบบ (S) คือการวัดระดับของความไม่เป็นระเบียบ ยิ่งองค์กรใหญ่ เอนโทรปียิ่งต่ำ เอนโทรปีเป็นลักษณะเฉพาะของสภาวะทางอุณหพลศาสตร์ เช่นเดียวกับพลังงานภายใน ปริมาตร และจำนวนโมล
เมื่อดูคอนเทนเนอร์ในรูปด้านบน เราจะเห็นว่าคอนเทนเนอร์ 1 มี a เอนโทรปี เล็กกว่าที่อื่น ถ้าเราเอาภาชนะมาเขย่า เราจะตรวจสอบว่า “ลูก” จะปะปนกันหรือไม่เป็นระเบียบ ถ้าเราตรวจสอบภาชนะที่ 2 หลังจากเขย่าแล้วเราจะสังเกตเห็นว่าเป็นไปไม่ได้สำหรับลูกบอล กลับคืนสู่องค์กรเดิมอย่างเป็นธรรมชาติ หากเรายังคงเขย่า ภาชนะ
ในกระบวนการคายความร้อนแบบผันกลับได้ (ซึ่งอุณหภูมิยังคงเท่าเดิมเสมอ) กระบวนการแบบย้อนกลับได้ เรากำหนดเอนโทรปีเป็นอัตราส่วนของความร้อน (ให้หรือรับ) ต่ออุณหภูมิ ดังนั้นเราจึงเป็นตัวแทนของเอนโทรปีในกระบวนการไอโซเทอร์มอลดังนี้:
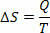
ในระบบหน่วยสากล เราวัดเอนโทรปีในหน่วยจูล/เคลวิน จากแนวคิดที่เราอธิบายเกี่ยวกับเอนโทรปี เราสามารถกำหนดกฎข้อที่สองได้ดังนี้:

การเปลี่ยนแปลงเอนโทรปีของระบบที่แยกได้นั้นเป็นค่าบวกหรือค่าว่างเสมอ ความเท่าเทียมกัน ΔS = 0 เกิดขึ้นเมื่อกระบวนการสามารถย้อนกลับได้: กระบวนการที่ย้อนกลับได้จะไม่เพิ่มเอนโทรปี ระบบที่แยกออกมาซึ่งไม่รับหรือให้ความร้อนต่อสิ่งแวดล้อมสามารถให้เอนโทรปีของพวกมันเพิ่มขึ้นหรือคงที่เท่านั้น
โดย Domitiano Marques
จบฟิสิกส์
ทีมโรงเรียนบราซิล
ที่มา: โรงเรียนบราซิล - https://brasilescola.uol.com.br/fisica/entropia-segunda-lei.htm
