กรดไฮโดรคลอริก เป็นไฮดราซิดที่มีศักยภาพในการแตกตัวเป็นไอออนสูง เป็นของเหลวสีเหลือง กัดกร่อนสูงและเป็นพิษ. ใช้ในกระบวนการทางอุตสาหกรรมต่างๆ เช่น การผลิตผลิตภัณฑ์ทำความสะอาดและยาไฮโดรคลอไรด์ ในอาหารและในกระบวนการผลิตเหล็ก
นอกจากนี้ยังมีอยู่ในสิ่งมีชีวิตของมนุษย์ อู๋ น้ำย่อยในกระเพาะอาหาร ซึ่งทำหน้าที่ในการย่อยอาหารของ โปรตีน เป็นสารละลายกรด ของไฮโดรคลอริกและสารอื่นๆ เช่น เอนไซม์ และ เกลือ. การรับสัมผัส การสูดดมหรือการกลืนกินของ กรดไฮโดรคลอริกเข้มข้นเป็นอันตรายต่อสุขภาพอย่างมากซึ่งอาจทำให้เสียชีวิตได้
อ่านด้วย: กรดกำมะถัน - สารที่มีฤทธิ์กัดกร่อนสูง
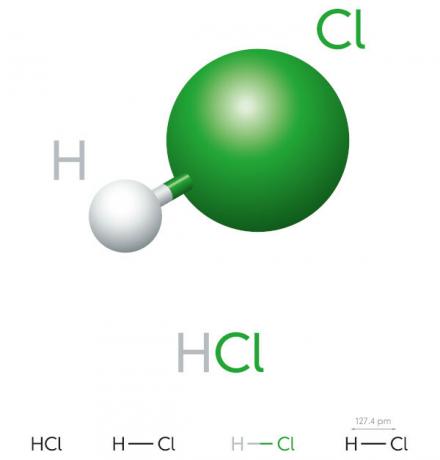
คุณสมบัติของกรดไฮโดรคลอริก
- สารประกอบอนินทรีย์
- กรดแก่
- ศักยภาพในการแตกตัวเป็นไอออนสูง
- ของเหลว
- ลักษณะสีเหลือง
- พิษ
- กัดกร่อน
- ระเหย
- ดูดความชื้น (มีแนวโน้มที่จะดูดซับt áน้ำ ของสิ่งแวดล้อม)
- ละลายน้ำได้
อย่าเพิ่งหยุด... มีมากขึ้นหลังจากโฆษณา ;)
การผลิตกรดไฮโดรคลอริก
กรดไฮโดรคลอริกคือ ค้นพบโดยนักเล่นแร่แปรธาตุมุสลิม muslim เรียกว่า Jabir Ibne Haiane หรือที่เรียกว่า Gaber และถือเป็นบิดาแห่งวิชาเคมีอาหรับ เขาสังเคราะห์สารตาม ปฏิกิริยาระหว่างเกลือทะเล (NaCl) กับ กรดซัลฟูริก (ที่2เท่านั้น4).
2NaCl + H2เท่านั้น4 → อิน2เท่านั้น4 + 2HCl
ปัจจุบันกรดไฮโดรคลอริก ถูกผลิตในปริมาณมากผ่าน อิเล็กทรอนิกส์óสลายตัว ของโซเดียมคลอไรด์ในสารละลายน้ำ จากขั้นตอนนี้จะได้ก๊าซ คลอรีน (Cl2), แก๊ส ไฮโดรเจน (H2) และ โซเดียมไฮดรอกไซด์ (NaOH). ก๊าซคลอรีนและไฮโดรเจนทำปฏิกิริยากับกรดไฮโดรคลอริก:
Cl2 + โฮ2 → 2HCl
อย่างไรก็ตาม ปฏิกิริยานี้เป็นอย่างมาก คายความร้อน และอันตรายมาก. ในปัจจุบัน กรดไฮโดรคลอริกที่ผลิตทางอุตสาหกรรมส่วนใหญ่เกี่ยวข้องกับการผลิตสารประกอบอินทรีย์ ซึ่งเป็นกระบวนการที่ประหยัดและปลอดภัยกว่า
R-H + Cl2 → R-Cl + HCl
(ถือว่า R เป็นอนุมูลอินทรีย์)
ดูด้วย: เคล็ดลับในการพิจารณา-ถ้า ความแรงของกรด

การใช้กรดไฮโดรคลอริก
- การดองโลหะ: กรดไฮโดรคลอริกใช้เพื่อ "ทำความสะอาด" โลหะก่อนที่จะผ่านกรรมวิธี ขจัดสนิม ตะกรัน และสิ่งสกปรกอื่นๆ ออกจากพื้นผิว
- การผลิตสารประกอบอินทรีย์: กรดไฮโดรคลอริกถูกใช้เป็นรีเอเจนต์เพื่อให้ได้ไวนิลคลอไรด์ซึ่งใช้ในการผลิตพลาสติก กรดไฮโดรคลอริกยังมาจากคลอโรพรีนซึ่งใช้ในยางสังเคราะห์
- การผลิตสารประกอบอนินทรีย์: กรดไฮโดรคลอริกมีอยู่ในกระบวนการทางอุตสาหกรรมหลายอย่างสำหรับสารทำปฏิกิริยาและสารประกอบในการผลิต ผลิตภัณฑ์อนินทรีย์ ได้แก่ ผลิตภัณฑ์สำหรับการบำบัดน้ำ เช่น เหล็ก (III) คลอไรด์และเหล็ก (III) คลอไรด์ อลูมิเนียม
- ใช้เป็นผลิตภัณฑ์ทำความสะอาด: ยังวางตลาดเป็นกรด muriatic กรดไฮโดรคลอริกใช้สำหรับทำความสะอาดเครื่องมือและเครื่องจักรหลังการก่อสร้างในบ้านและด้วยสารเคมี
- กระบวนการทำอาหาร: กรดไฮโดรคลอริกถูกนำมาใช้ในปฏิกิริยาหลายอย่างสำหรับการผลิตอาหารและสารเติมแต่ง เช่น การไฮโดรไลซิสของแป้งและโปรตีน หรือในผลิตภัณฑ์ขั้นสุดท้ายเพื่อความสมดุลของค่า pH
- การผลิตยา: กรดไฮโดรคลอริกใช้ในการผลิตไฮโดรคลอไรด์ที่ละลายน้ำได้ในยาหลายชนิด เช่น ด็อกซีไซคลิน ไฮโดรคลอไรด์ ซึ่งใช้ในการรักษา ไข้ไทฟอยด์ และ ไข้ทรพิษ.
กรดไฮโดรคลอริกในร่างกาย
กรดไฮโดรคลอริกมีอยู่ในตัวของเรา ระบบทางเดินอาหารน้ำย่อยที่ผลิตโดยกระเพาะอาหารของเราคือสารละลายของน้ำ เอนไซม์ กรดไฮโดรคลอริก เกลืออนินทรีย์ และกรดแลคติกเพียงเล็กน้อย
อู๋ เค้กอาหารถูกแปลงเป็น chyme, มวลที่เป็นกรด (ต้องขอบคุณการกระทำของน้ำย่อยและองค์ประกอบที่เป็นกรด) นี่คือเมื่อ การย่อยอาหารของ โปรตีน, แปลงร่างเป็น โพลีเปปไทด์ และ กรดอะมิโน ที่ร่างกายจะดูดซึม
อันตรายจากกรดไฮโดรคลอริก
กรดไฮโดรคลอริกเป็นกรดที่มีฤทธิ์กัดกร่อนรุนแรงมาก ดังนั้นการสัมผัสกับสารจะทำให้เกิดความเสียหายหลายประการ:
- ผิวหนัง: ทำให้เกิดแผลไหม้และระคายเคือง.
- ตา: ระคายเคืองอย่างรุนแรงและอาจทำให้ตาบอดได้
- การหายใจเข้า: ทำให้เกิดการระคายเคืองและบาดเจ็บที่ทางเดินหายใจส่วนบน.
- การกลืนกิน: ทำให้เกิดการกัดกร่อนทั่วช่องปาก และในทางเดินอาหาร อาจทำให้อาเจียน เลือดออก ท้องร่วง ปัญหาการไหลเวียนโลหิตจนเสียชีวิตได้
- การรับสัมผัสเชื้อยังมีต่อ: โจมตีบริเวณเยื่อเมือกก่อน ทำให้เกิดโรคผิวหนังและ ตาแดง, เลือดออกตามไรฟัน, ไวแสง; การหายใจเข้าไปบ่อยครั้งแม้ในความเข้มข้นต่ำของสารประกอบก็สามารถทำให้ โรคกระเพาะ และเลือดกำเดา
เข้าถึงด้วย: ลักษณะและคุณสมบัติของกรดอะซิติก

แก้ไขแบบฝึกหัด
คำถามที่ 1 - (Udesc) เกี่ยวกับกรดไฮโดรคลอริก อาจกล่าวได้ว่า:
ก) เมื่ออยู่ในสารละลายน้ำจะช่วยให้กระแสไฟฟ้าไหลผ่านได้
B) เป็นไดแอซิด
C) เป็นกรดอ่อน
D) มีระดับไอออไนซ์ต่ำ
E) เป็นสารไอออนิก
ความละเอียด
ทางเลือก ก. กรดไฮโดรคลอริกไม่ใช่ไดอะซิดเพราะมี H เพียงหนึ่งตัวที่แตกตัวเป็นไอออนได้ แต่มีหนึ่งตัว กรดแก่, สารโมเลกุลที่มีศักยภาพในการแตกตัวเป็นไอออนสูง THE ไอออไนซ์ ในตัวกลางที่เป็นน้ำส่งเสริมการนำของ กระแสไฟฟ้า เนื่องจากการมีอยู่ของไอออนอิสระ
คำถามที่ 2 - ในสารละลายกรดไฮโดรคลอริกและน้ำ เราสามารถพูดได้ว่าโมเลกุลไฮโดรเจนคลอไรด์ (HCl) เกิดขึ้นน้อยมาก เป็นเพราะ
ก) กรดไฮโดรคลอริกที่สัมผัสกับน้ำจะเจือจาง
ข) ไฮโดรเจนคลอไรด์เป็นสารที่ไม่ละลายในน้ำ
C) ไฮโดรเจนคลอไรด์มีศักยภาพในการแตกตัวเป็นไอออนสูง ดังนั้น เมื่อในตัวกลางที่เป็นน้ำ โมเลกุล HCl จะสร้างไอออน H+ Cl-.
D) กรดไฮโดรคลอริกเนื่องจากระเหยง่ายแยกออกจากสารละลายเหลือเพียงโมเลกุลของน้ำ
E) กรดไฮโดรคลอริกเป็นสารไอออนิกดังนั้นในสารละลายที่เป็นน้ำจะแยกตัวออกเป็นไอออน
ความละเอียด
ทางเลือก C
A) คำตอบไม่เห็นด้วยกับคำถาม การเจือจางกรดไฮโดรคลอริกในน้ำไม่ได้แสดงว่าไม่มีโมเลกุล HCl
B) ไม่ถูกต้อง ไฮโดรเจนคลอไรด์สามารถละลายได้และมีความสัมพันธ์กับน้ำ
ค) ถูกต้อง
D) แม้ว่ากรดไฮโดรคลอริกจะมีความผันผวน แต่การแยกตัวของทั้งสองชนิดในสารละลายนี้ไม่ได้เกิดขึ้นอย่างมีนัยสำคัญ
E) กรดไฮโดรคลอริกเป็นสารละลายของไฮโดรเจนคลอไรด์และน้ำ โดยที่ไฮโดรเจนคลอไรด์เป็นสารโมเลกุลที่ไม่ใช่ไอออนิก
โดย Laysa Bernardes Marques de Araujo
ครูสอนเคมี
คุณต้องการอ้างอิงข้อความนี้ในโรงเรียนหรืองานวิชาการหรือไม่ ดู:
ARAúJO, Laysa Bernardes Marques เดอ "กรดไฮโดรคลอริก"; โรงเรียนบราซิล. มีจำหน่ายใน: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. เข้าถึงเมื่อ 27 มิถุนายน 2021.
