Den elektroniska fördelningen av en atoms elektroner i neutralt eller grundläggande tillstånd utförs vanligtvis med Pauling-diagram, visas nedan:
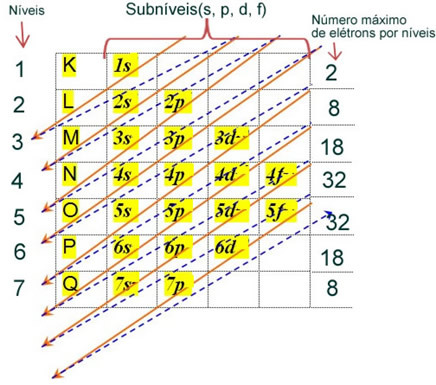
De detaljerade reglerna för denna distribution finns i följande två texter på vår webbplats: ”Elektronisk distribution av elektroner"och"Elektroniska distributionsregler”.
Den elektroniska distributionen av joner fungerar initialt på samma sätt som för atomer i neutralt tillstånd; med bara en skillnad. Eftersom en jon är en atom som har fått eller förlorat elektroner måste vi ta hänsyn till detta och göra följande:

En viktig observation är: förändringen sker på det yttersta undernivån och inte den mest energiska.
om jonen är en katjon, vi måste ta bort elektronerna att han förlorade. Låt oss titta på ett exempel:
Järnatomen (atomnummer = 26) har följande elektroniska fördelning i undernivåerna i energisk ordning: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. När det gäller de elektroniska lagren har vi: K =2; L = 8; M = 14; N = 2.
Denna fördelning visas i Pauling-diagrammet nedan:
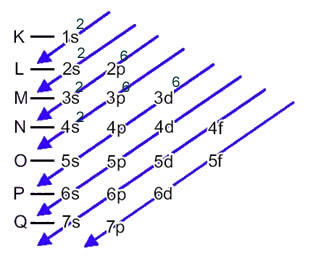
När järnatomen förlorar 2 elektroner förvandlas den till Fe-katjonen.2+. Så när du gör din elektroniska distribution måste vi ta bort 2 elektroner från det sista skalet(N) och inte det mest energiska undernivån, enligt nedanstående:
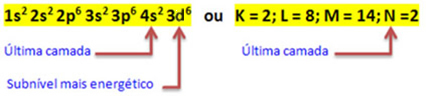
Således den elektroniska distributionen av Fe-katjonen2+ ges av:
1s2 2s2 2p6 3s2 3p6 3d6 eller K = 2; L = 8; M = 14
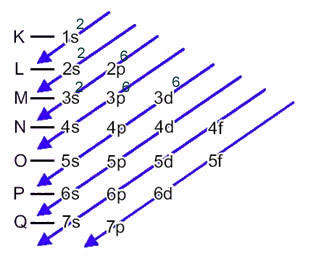
Nu, om vi måste utföra den elektroniska distributionen av en anjon, vi måste lägg till de elektroner den fick.Se hur detta görs i följande exempel:
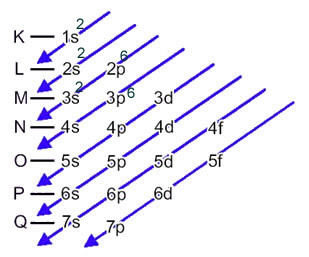
Svavelanjonen (16s2-) bildas från svavelatomen (16S) genom förstärkning av 2 elektroner, vilket indikeras av laddning 2-. Dess elektroniska distribution av marktillstånd ges av:
1s2 2s2 2p6 3s2 3p4 eller K = 2; L = 8; M = 6
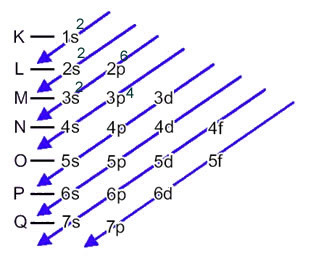
I detta fall är den sista delnivån densamma som energidelenivån, 3p. Så vi lägger till de två svavelanjonernas elektroner:
1s2 2s2 2p6 3s2 3p6 eller K = 2; L = 8; M = 8
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm
