Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) var en italiensk kemist som först grundade idén att en prov av ett element, med massa i gram numeriskt lika med sin atommassa, har alltid samma antal atomer (N).
Avogadro själv kunde inte bestämma värdet av N. Under hela 1900-talet gjorde utvecklingen av teknik och vetenskaplig kunskap det dock möjligt för andra forskare att utveckla tekniker för att bestämma det. När detta värde äntligen upptäcktes kallades det Avogadro är konstant, till ära för denna forskare, eftersom det var han som lade grunden för dess skapande.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
I 1 mol av vilken enhet som helst (atomer, molekyler, elektroner, formler eller joner) finns exakt värdet på Avogadros konstant.
Tabellen nedan visar några värden för Avogadros konstant som erhållits under 20-talet:
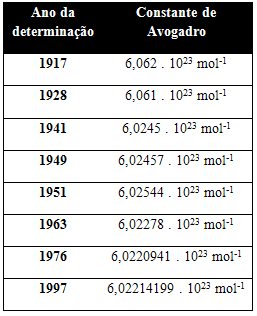
Här är några av de tekniker som används för att försöka bestämma värdet på Avogadros konstant:
Den första forskaren som gjorde en ungefärlig beräkning för Avogadros konstant var Johann Joseph Loschmidt. År 1867 baserade han sig på den kinetiska teorin om gaser och bestämde hur många molekyler som fanns i 1 cm
3 av en gas.En annan av dessa forskare var fransmannen Jean Baptiste Perrin (1870-1942) som räknade antalet kolloidala partiklar per volymenhet i en suspension och mätte deras massor. Värdet han hittade var mellan 6,5 och 7,2. 1023 enheter per mol. Denna forskare publicerade 1913 boken Les Atomes (1: a upplagan Paris: Alcan) och dess 9: e upplagan, publicerad 1924, innehöll 16 sätt att experimentellt få Avogadros konstant.
Sluta inte nu... Det finns mer efter reklam;)

Jean Baptiste Perrin (1870-1942)
År senare använde forskaren James Dewar (1842-1923) en metod som utvecklades år tidigare av radiokemisten Bertram Boltwood (1870-1927) och fysikern Ernest Rutherford (1871-1937), som i grunden bestod av att räkna de alfapartiklar som emitteras av en radioaktiv källa och bestämma volymen av erhållen heliumgas. Värdet som Dewar hittade var 6,04. 1023 mol-1.
Tillbaka på 1900-talet genomförde Robert Millikan (1868-1953) ett experiment för att bestämma elektronens laddning (1.6. 10-19 Ç). Eftersom laddningen av 1 mol elektroner redan var känd (96500 C) var det möjligt att relatera dessa två värden och hitta följande värde för Avogadros konstant: 6,03. 1023 mol-1.
För närvarande är det rekommenderade värdet för Avogadros konstant 6.02214 x 1023 mol-1 och det bestäms med hjälp av röntgendiffraktion, i vilken volymen av ett fåtal atomer i ett kristallint galler erhålls så länge som densiteten och massan av 1 mol atomer i provet är känd.
För didaktiska ändamål i High School, där beräkningarna inte behöver vara så exakta som de som utförs i kemiska laboratorier, anses Avogadros konstant vara som 6,02. 1023 mol-1.
Det finns också enklare metoder som kan användas för att hjälpa eleverna att bestämma Avogadros konstant i praktiken. En av dem är genom elektrolys i ett vattenhaltigt medium.
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Bestämning av Avogadros konstant"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. Åtkomst den 28 juni 2021.


