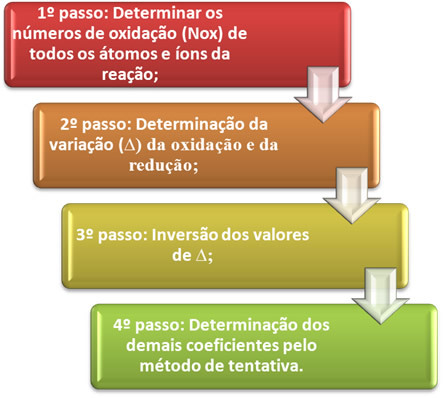
О. балансирање једначине редукције оксидације заснива се на једнакости броја електрона који се поклањају са бројем примљених електрона. Једноставан метод извођења овог балансирања дат је у следећим корацима:
Погледајмо у пракси како применити ове кораке кроз следећи пример:
Реакција између воденог раствора калијум перманганата и хлороводоничне киселине:
кмнО4 + ХЦл → КЦл + МнЦл2 + Кл2 + Х2О.
*1. корак:Одредити оксидационе бројеве:
Овај корак је важан јер обично не можемо брзо да замислимо које врсте се подвргавају оксидацији и редукцији.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
кмнО4 + ХЦл → КЦл + МнЦл2 + Кл2 + Х2О.
*2. корак:Одређивање варијација оксидације и редукције:

Имајте на уму да је манган (Мн) редукован, а хлор (Цл) оксидисан.
МнЦл2 = ОкНок = 5
Кл2 = ОкНок = 2
У случају хлора, можемо приметити да је ХЦл дао 3 једињења (КЦл, МнЦл2, и Цл2), али оно што нас занима је кл2, јер је ваш Нок претрпео промене. Сваки хлор који ствара Цл2 изгубити 1 електрон; пошто су за формирање сваког Цл потребна 2 хлора2, тада се губе два електрона.
3. корак:Инверзија вредности ∆:
У овом кораку се вредности ∆ размењују између поменутих врста, постајући њихови коефицијенти:
МнЦл2 = ОкНок = 5 → 5 биће коефицијент Цл2
Кл2 = ОкНок = 2→ 2 биће коефицијент МнЦл2
кмнО4 + ХЦл → КЦл + 2 МнЦл2 + 5 Кл2 + Х2О.
У овом тренутку је већ могуће знати два коефицијента једначине.
Посматрање: нормално се у већини реакција ово преокретање вредности врши на 1. члану. Али, по општем правилу, то би требало радити код члана који има највећи број атома који се подвргавају редоксу. Ако овај критеријум не може бити задовољен, претварамо вредности за члана са највећим бројем хемијских врста. То је овде урађено, јер 2. члан има више супстанци.
Не заустављај се сада... После оглашавања има још;)
4. корак: Пробно балансирање:
кмнО4 + ХЦл → КЦл + 2 МнЦл2 + 5 Кл2 + Х2О.
- Будући да у другом члану постоје два атома мангана, као што показује коефицијент, у првом их такође мора бити. Тако имамо:
2 кмнО4 + ХЦл → КЦл + 2 МнЦл2 + 5 Кл2 + Х2О.
- Тако је количина калијума (К) у првом члану била 2, што ће бити исти коефицијент за овај атом у другом члану:
2 кмнО4 + ХЦл → 2 КЦл + 2 МнЦл2 + 5 Кл2 + Х2О.
- Количина хлора (Цл) у другом члану је укупно 16, тако да ће коефицијент ХЦл првог члана бити:
2 кмнО4 + 16 ХЦл → 2 КЦл + 2 МнЦл2 + 5 Кл2 + Х2О.
- Број водоника у 1. члану је 16, отуда и коефицијент воде (Х2О) 2. члана биће једнако 8, јер је множење индекса водоника (2) са 8 једнако 16:
2 кмнО4 + 16 ХЦл → 2 КЦл + 2 МнЦл2 + 5 Кл2 + 8 Х.2О.
- Да бисмо проверили да ли је једначина правилно уравнотежена, можемо видети два критеријума:
1.) Проверите да ли је количина сваког атома у два члана једнака:
2 кмнО4 + 16 ХЦл →2 КЦл + 2 МнЦл2 + 5 Кл2 + 8 Х.2О.
К = 2К = 2
Мн = 2 Мн = 2
Цл = 16 Цл = 16
Х = 16 Х = 16
О = 8 О = 8
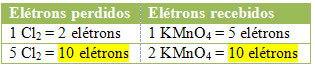
2.) Погледајте да ли је укупан број изгубљених електрона једнак укупном броју примљених електрона:
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Роки-редукционо балансирање“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Приступљено 28. јуна 2021.