ТХЕ Теорија октета каже да да би атом хемијског елемента био стабилан, он мора да стекне електронску конфигурацију племенитог гаса, то јест мора имати осам електрона у валентној љусци или два електрона ако атом има само прву електронску љуску. (К).
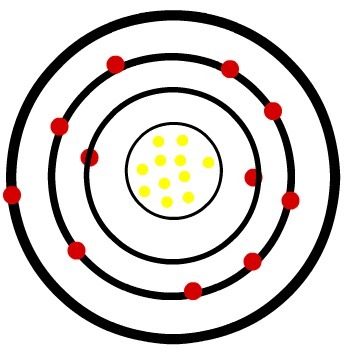
Берилијум има атомски број једнак 4. Према томе, ваш атом има 4 електрона и његова електронска расподела у основном стању је дата са:

Електронска конфигурација берилијума
То значи да берилијум има 2 електрона у последњој љусци, који су из породице 2А (земноалкални метали). Дакле, имала би тенденцију да донира ова два електрона, добијајући наелектрисање 2+, односно имала би тенденцију да формира јонске везе.
Међутим, примећено је да атоми берилијума стварају ковалентне везе, делећи електроне, као што је приказано у једињењу насталом доле, берилијум хидрид (БеХ2):
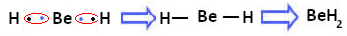
Стварање ковалентних веза берилијума са водоником
Имајте на уму да је у овом случају берилијум стабилан са мање од осам електрона у својој валентној љусци, јер дели своје електроне попут атома водоника, сада има четири електрона у последњем слој. То је, дакле, а
изузетак од правила октета.Али до ковалентне везе обично долази зато што елемент има непотпуне орбитале. На пример, као што је приказано доле, водоник има непотпуну орбиталу, па ствара само једну ковалентну везу. Кисеоник има две непотпуне орбитале и прави две ковалентне везе. Азот заузврат има три непотпуне орбитале и, сходно томе, ствара три ковалентне везе:
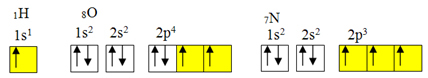
Електронска дистрибуција водоника, кисеоника и азота
Међутим, као што је већ приказано, берилијум нема непотпуне орбитале.
Не заустављај се сада... После оглашавања има још;)
Па зашто онда ствара ковалентне везе?
Објашњење је у теорија хибридизације, који то говори када електрон са орбитале прими енергију, он „скочи“ на најудаљенију празну орбиталу, задржавање у побуђеном стању и тако долази до фузије или мешања непотпуних атомских орбитала, генеришући хибридне орбитале који су међусобно еквивалентни и различити од изворних чистих орбитала.
На пример, у случају берилијума, електрон из поднивоа 2с прима енергију и прелази на празну орбиталу поднивоа 2п:

Побуђено стање берилија за формирање хибридних орбитала
На овај начин, берилијум има две непотпуне орбитале, будући да може да направи две ковалентне везе.
Имајте на уму да је једна орбитала у поднивоу „с“, а друга у „п“, тако да би везивања која би берилијум требало да врши треба да буду другачија. Међутим, то се не дешава, јер са феноменом хибридизација, ове непотпуне орбитале које су се формирале измешаће се, генеришући две тзв хибриди или хибридизован, који су међусобно једнаки. Даље, с обзиром да су ове две хибридне орбитале дошле са орбитале "с" и "п", кажемо да је ова хибридизација типа сп:

Формирање сп хибридизације берилија
Будући да су хибридне орбитале исте, ковалентне везе које берилијум прави са атомима водоника такође ће бити исте:

Интерпенетрације хибридних берилијумских орбитала са с орбитала водоника
Имајте на уму да тада прави две сигма везе типа с-сп (σс-сп).
Јеннифер Фогаца
Дипломирао хемију