ТХЕ ауто-окси-редукција или несразмерна реакција је врста редокс реакције у којој се исти хемијски елемент подвргава оксидација и смањење. Погледајмо два примера ове врсте реакција и како их уравнотежити редокс методом:
1. пример:
АТ ТХЕ2- + Х+ → НЕ3- + НЕ + Х.2О.
- Израчунавањем оксидационих бројева (НОКС) свих атома и јона који учествују у реакцији, могуће је проверити ко је оксидисао, а ко реаговао:
+3 -2 +1 +5 -2 +2 -2 +1 -2
АТ ТХЕ2- + Х+ → НЕ3- + НЕ + Х.2О.
- Имајте на уму да је азот врста која је реаговала и оксидирала:
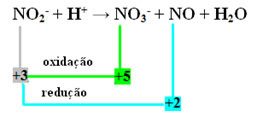
- Да бисмо извршили редокс балансирање ове реакције, НОКС морамо повезати са производима, а не са реактантима:
АТ ТХЕ3- = ОкНок = 5 - 3 = 2
НО = окНок = 3 - 2 = 1
- Инвертујући ∆НОКС коефицијентима, имамо:
АТ ТХЕ3- = ∆НОКС = 2 → 2 биће коефицијент НО
НО = ∆НОКС = 1→ 1 биће коефицијент НО3-
АТ ТХЕ2- + Х+ → 1 АТ ТХЕ3- + 2 НЕ + Х.2О.
- Тако већ знамо да у производу има 3 Н, дакле коефицијент НО2- биће 3:
3 НЕ2- + Х+ → 1 НЕ3- + 2 НЕ + Х.2О.
- Да би се утврдили коефицијенти Х.+ и од Х.2О, запамтите да је број примљених електрона једнак истој количини донираних електрона; тако ће пуњење реагенса бити једнако пуњењу производа. На овај начин можемо направити следећу шему:
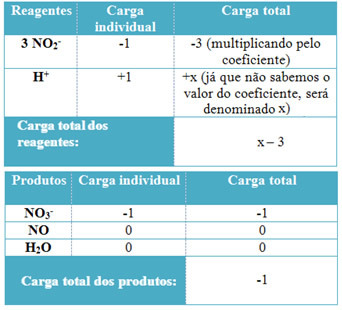
Не заустављај се сада... После оглашавања има још;)
На основу ових података имамо да је укупан набој реагенаса једнак к - 3 а производ је једнак -1. Као што је наведено, оптужбе њих двојице морају бити једнаке. Како већ имамо укупно оптерећење производа, можемо извршити једноставан прорачун да бисмо знали колика ће бити вредност к:
к -3 = -1
к = -1 +3
к = 2
Дакле, коефицијент Х.+ је 2 и, сходно томе, онај Х.2Биће 1:
3 НЕ2- + 2 Х.+ → 1 НЕ3- + 2 НО + 1 Х.2О.
2. пример:
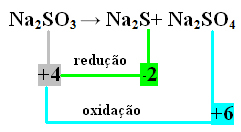
У овом случају, управо је С био подвргнут редукцији и оксидацији истовремено. Дакле, као што је претходно учињено, НОКС можемо повезати са производима и обрнути њихове вредности, додељујући им коефицијенте:
У2 С = окНок = 4 - (-2) = 6 → 6 биће коефицијент На2 САМО4
У2 САМО4= ОкНок = 6 - 4 = 2 → 2 биће коефицијент На2 с
У2 САМО3→ 2 У2 И + 6 У2 САМО4
С обзиром да у другом краку има 8 сумпора, На коефицијент2 САМО3 биће 8:
8 ин2 САМО3→ 2 ин2 С + 6 у2 САМО4
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Реакције самооксидације“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Приступљено 28. јуна 2021.