Да би дошло до хемијске реакције потребно је задовољити четири основна услова, а то су:
1. Реагенси морају да контактирају;
2. Између реагенса мора постојати хемијски афинитет;
3. Судари између честица реагенса морају бити ефикасни;
4. Мора се постићи енергија активирања.
Укратко погледајте сваки случај:
1.Контакт између реагенса:
Ово стање је очигледно, јер чак и ако реактанти имају пуно афинитета једни за друге, као у случају киселина и база, ако се одвоје, реакција се неће догодити. Морају да дођу у контакт како би се њихове честице могле сударити, прекидајући везе реактаната и формирајући везе производа.

2.Хемијски афинитет:
Као што смо видели, довођење реагенаса у контакт је неопходно, али недовољно. На пример, ако ставимо натријум у контакт са водом, догодиће се изузетно бурна реакција, али ако ставимо злато, нећемо видети никакву разлику. То је зато што различите супстанце међусобно имају различите хемијске афинитете или можда уопште немају афинитет. Што је већи хемијски афинитет, реакција је бржа.
У поменутим примерима натријум има велики афинитет са водом, толико да се метални натријум, како не би дошао у контакт са влагом у ваздуху, складишти у керозину. Злато је инертно, због чега споменици злата трају толико дуго, попут саркофага у Египту.

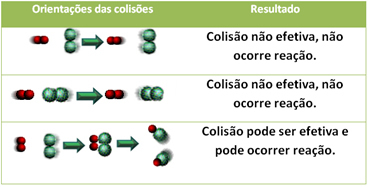
3.Теорија судара:
Чак и у једињењима која имају хемијски афинитет, да би реакција текла неопходно је да се њихове честице, атоми или молекули ефикасно сударају. Нису све честице које се сударају то раде ефикасно, али ударци који резултирају ломљењем реагенске везе и стварање нових веза су оне које се јављају у правилној оријентацији и са енергијом довољно.
Не заустављај се сада... После оглашавања има још;)
Испод је приказан случај два неефикасна судара и једног ефикасног судара који резултирају реакцијом.
4.Енергија активације и активирани комплекс:
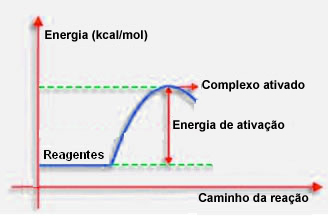
Као што је речено у претходној тачки, за ефикасан судар, поред повољних смерница, потребна је и довољна енергија. Минимална количина енергије потребна за сваку реакцију која се одвија назива се енергија активације.
Ако реактанти имају енергију једнаку или већу од енергије активирања, током добро оријентисаног шока, формираће се иницијално активирани комплекс, који је средња структура између реактаната и производи. У активираном комплексу постоје ослабљене везе реагенса и стварање нових веза производа.
Дакле, енергија активације делује као нека врста баријере за настанак реакције, јер што је већа, то ће бити теже да се реакција догоди. У неким случајевима је потребно реагенсе снабдевати енергијом. На пример, гас за кување има афинитет за интеракцију са кисеоником у ваздуху, али морамо да испоручујемо енергију када спојимо шибицу, иначе се реакција не одвија. Али једном започета реакција сама ослобађа довољно енергије да активира остале молекуле и одржи реакцију.
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Услови за настанак хемијских реакција“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/condicoes-para-ocorrencia-reacoes-quimicas.htm. Приступљено 27. јуна 2021.