Реакције сулфонирања у алканима су реакције органске супституције, изведена са циљем производње сулфонске киселине (органска једињења која имају СО групу3Х везан за атом угљеника или за ланац угљеника) и вода (Х.2О).
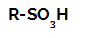
Структурна формула сулфонске киселине
За извођење реакције сулфонирања на алкани, морамо мешати алкан (једињење настало угљеничним ланцем засићеним само атомима угљеника и водоника) и сумпорна киселина (Х2САМО4) концентрован, подвргнут загревању (∆).
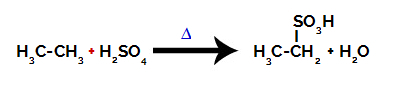
Хемијска једначина која представља сулфонацију двокарбонског алкана
Принципи реакције сулфонирања у алканима
Као такав реакција сулфонирања алкана то је реакција супституције, у њој имамо размену између мањих компонената електронегативност реактаната, односно између алкана и сумпорне киселине. Алкан има водоник и сумпорну киселину, сулфонску групу.
Испод имамо корак по корак механизма а реакција сулфонације у алканима. Као пример користићемо најједноставнији алкан, метан (ЦХ4):
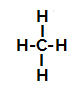
Структурна формула метана
1. корак: Прекид везе између хидроксила (ОХ) и сумпора (С) у сумпорној киселини.
Свака хидроксилна група присутна у сумпорној киселини карактерише се тиме што је више електронегативна. Са загревањем током реакције, тенденција је да се веза између хидроксилне групе и сумпора прекине:
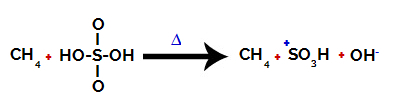
Прекид везе између сумпора и хидроксила
Међутим, до прекида везе свих хидроксила не долази због електронског престројавања у структури. Затим се добија хидроксид анион (ОХ).-) и сулфонски катион.
2. корак: Напад хидроксилне групе на молекул алкана.
Затим хидрокси група (ОХ-) врши напад на алкан, узрокујући прекид везе између угљеника и водоника (који је крхкији због разлике у електронегативности између њих).
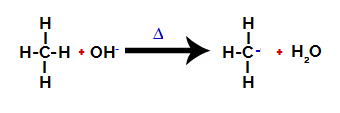
Прекидање везе између угљеника и водоника у алкану
Белешка: Прекид везе између угљеника и водоника увек ће се најчешће јављати на угљенику мање електронске густине или наелектрисања. Што мање угљеника има угљеник или је за њега везано више група, то је његова електронска густина мања. Тако имамо:
Терцијарни угљеник
Након прекида везе, алкан постаје угљеник са недостатком електрона (карбокација). Хидроксидна група (ОХ)-) реагује са ослобођеним водоником и формира молекул воде.
3. корак: Напад формираног радикала на сулфонску групу.
На крају, остатак алкана напада сулфонску групу, формирајући сулфонску киселину.
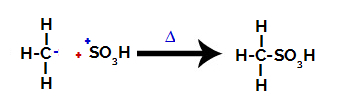
Структуре које међусобно делују и формирају сулфонску киселину
Примери једначина које представљају реакције сулфонације у алканима
1. пример: Сулфонизација пропана.
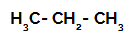
Структурна формула пропана
Пропан има два примарна угљеника и један секундарни угљеник, који имају различита наелектрисања, јер су везани за различите количине водоника. Будући да је угљеник електронегативнији од водоника, ови угљеници имају различиту густину електрона.
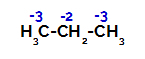
Расподела наелектрисања на сваком атому угљеника пропана
На примарним угљеницима наелектрисање је -3 (јер је везано за три водоника), а на секундарном угљенику наелектрисање -2 (јер је везано за два водоника). Тако ће доћи до прекида везе између угљеника и водоника, понекад на угљенику 1 (једног молекула), понекад на угљенику 2 (другог молекула).
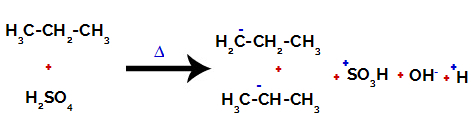
Прекидање везе између угљеника и водоника на различитим угљеницима
После прекида између веза, како у сумпорној киселини, тако и у алкану, долази до стварања производи са заменом водоника на угљенику 1 сулфонском групом, а исто се дешава и са угљеником 2.
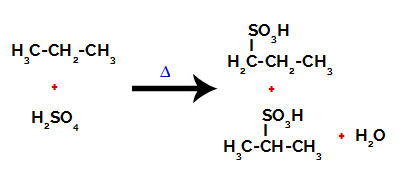
Производи настали сулфонирањем пропана
2. пример: Сулфонирање 2-метил-бутана.

Структурна формула 2-метил-бутана
2-метил-бутан има три примарна угљеника, секундарни угљеник и терцијарни угљеник, који имају различити набоји и, сходно томе, различите електронске густине, што се може видети у следећој структури:
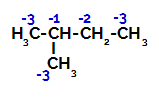
Расподела електронских наелектрисања у 2-метил-бутану
Према томе, у 2-метил-бутану постоји неколико могућности да се прекине веза између угљеника и водоника, који се могу јавити на угљенику 1 (молекула), угљенику 2 (другог молекула), угљенику 3 или угљенику 4. Међутим, вреди напоменути да су поремећаји на угљенику број 2 чешћи.
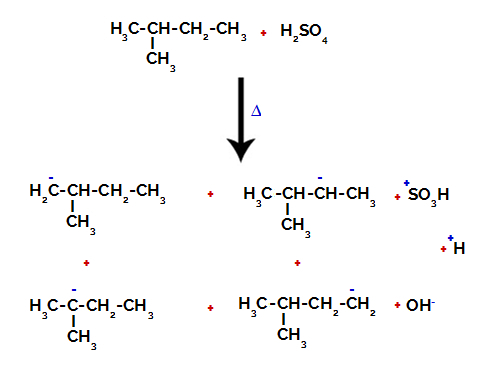
Прекидање везе између угљеника и водоника на различитим угљеницима
После прекида између веза, како у сумпорној киселини, тако и у алкану, настаје производи са заменом водоника на угљенику 1 сулфонском групом, а исто се дешава и на угљеник 2.

Производи настали сулфонирањем 2-метил-бутана
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
