дифузија и излив су два закона која је у 19. веку предложио шкотски хемичар Тхомас Грахам, на основу својих студија о мешавине гасова и понашање гасови приликом проласка кроз зидове контејнера.
Међу запажањима Томаса Грахама о понашању гасова у односу на дифузију и излив, можемо истаћи следеће:
Гас увек има тенденцију да пролази кроз мале рупе присутне у чврстом материјалу;
Што је већи маса молекула гас, то је већа његова потешкоћа при проласку кроз рупе чврсте материје;
Што је мања густина гаса, већа му је брзина кретања;
Што је виша температура којој је гас подвргнут, то је већа брзина којом се шири у околину или пролази кроз отвор;
- Гас никада не остаје статичан на одређеном месту.
Дифузија
Дифузија то је физички феномен који се састоји у способности гаса да се дифузно (односно да се шири) кроз простор подручја или унутар посуде. Из тог разлога можемо рећи да се у простору гас никада не ограничава на једно место.

Приказ појаве емитовања
Поред тога, можемо дефинисати и дифузија још увек као капацитет који један гас мора да помеша са другим, када се стави у исти контејнер, формирајући хомогену гасовиту смешу.
Пример је када гасови излазе из издувних гасова возила. Колико год да су токсични, не узрокују краткотрајну штету човеку, јер се шире по атмосферском ваздуху, што последично смањује њихову концентрацију.
Излив
Излив то је физички феномен који се састоји у проласку гаса кроз рупе које постоје у зидовима одређеног контејнера, односно састоји се у излазу гаса из једне средине у другу.

Приказ појаве изливања
Пример је када се балони надувају за забаву, а следећег дана сви се испушу, све због ваздуха који излази кроз рупе у балонима.
Прорачуни везани за дифузију и излив
Према једначинама које је предложио Грахам, можемо израчунати брзину којом гас делује дифузија или излив. Према Грахаму, брзине дифузије и изливања два гаса помешана у посуди су увек обрнуто пропорционални квадрату њихове релативне густине или моларних маса.
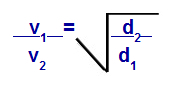
Грахамов закон с обзиром на густину
в1 = брзина (изливање или дифузија) гаса 1 у смеши;
в2 = брзина (изливање или дифузија) гаса 2 у смеши;
д1 = густина гаса 1 смеше;
д2 = густина гаса 2 смеше;
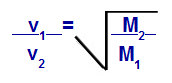
Грахамов закон о моларној маси
в1 = брзина (изливање или дифузија) гаса 1 у смеши;
в2 = брзина (изливање или дифузија) гаса 2 у смеши;
М.1 = моларна маса гаса 1 смеше;
М.2 = моларна маса гаса 2 у смеши.
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm