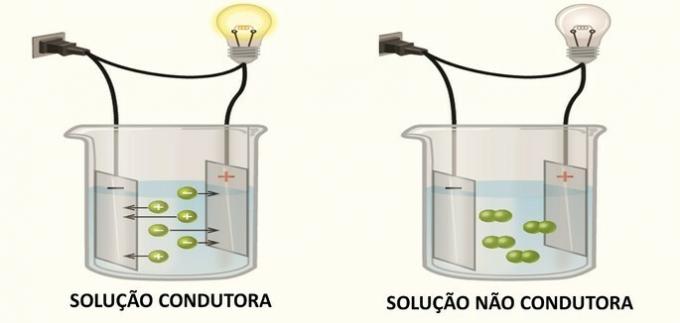
а) само везујући електронски парови могу да одреде геометрију молекула.
б) парови електрона око централног атома молекула понашају се као електронски облаци и међусобно се одбијају.
в) Молекуларна геометрија је резултат привлачења централног атома молекула невезујућим електронима.
г) што је већи број централних атома у молекулу, структура може имати различите геометрије.
Теорија одбијања пара електрона валентне љуске је модел који се користи за предвиђање геометрије молекула.
Централни атом молекула има парове електрона који могу или не морају учествовати у везама. Ови валентни електрони се понашају као електронски облаци и одбијају једни друге и оријентишу се формирајући највећу могућу удаљеност.
Ако елемент Кс са атомским бројем 1 формира хемијску везу са елементом И са атомским бројем 9. Која је молекуларна геометрија формираног једињења?
Сви двоатомски молекули, односно формирани од само два атома, имају линеарну геометрију.
Елемент са атомским бројем 1 је водоник (Х), а елемент са атомским бројем 9 је флуор (Ф), који су повезани ковалентном везом и формирају флуороводоничну киселину (ХФ).
Кисеоник је најзаступљенији елемент на планети Земљи. Налази се у саставу два молекула неопходна за опстанак живих бића: гас кисеоника (О2) и воду (Х2О).
а) ПОГРЕШНО. Упркос томе што има само хемијски елемент кисеоник, гас кисеоника је двоатомски молекул, јер га формирају 2 атома елемента. Молекул воде се састоји од два атома водоника и једног атома кисеоника и стога је троатомски.
б) ПОГРЕШНО. Гас кисеоника је линеаран молекул јер се састоји од 2 атома. Молекул воде је угао, јер централни атом, кисеоник, поред тога што прави две ковалентне везе, има два доступна пара електрона.
в) ИСПРАВНО. Атом кисеоника је централни атом молекула воде. Гас кисеоника има два атома повезана ковалентном везом.
г) ПОГРЕШНО. Угао везе молекула гаса кисеоника је 180° јер је линеаран. Молекул воде има угао од 104,5º.
Правилно повежите молекул у колони И са његовом одговарајућом геометријом у колони ИИ.
ХЦН: линеарна геометрија
Молекули са три атома, чији је централни атом везан за два друга атома и не садржи пар доступних упарених електрона, имају линеарну геометрију.
НОЦл: угаона геометрија
Молекули са три атома, чији је централни атом везан за два друга атома и садржи пар доступних упарених електрона, показују угаону геометрију.
САМО3: планарна тригонална геометрија
Молекули са четири атома, чији је централни атом везан за три друга атома и не садржи пар доступних упарених електрона, имају планарну тригоналну геометрију.
НХ3: пирамидална геометрија
Молекули са четири атома, чији је централни атом везан за три друга атома и садржи пар доступних упарених електрона, имају пирамидалну геометрију.
ЦХ4: тетраедарска геометрија
Молекули са пет атома, чији је централни атом везан за четири друга атома и не садржи пар доступних упарених електрона, имају тетраедарску геометрију.
ПЦл5: бипирамидална геометрија
Молекули са шест атома, чији је централни атом повезан са пет других атома, имају бипирамидалну геометрију, независну од централног атома.
СФ6: октаедарска геометрија
Молекули са седам атома, чији је централни атом повезан са шест других атома, имају октаедарску геометрију, независну од централног атома.
Што је већи број атома у молекулу, то је већи број могућих молекулских геометрија. У случају троатомских молекула, они могу имати линеарну или угаону геометрију.
Следе примери молекула са доступним паровима електрона на централном атому који дају угаону геометрију молекула, ОСИМ:
Молекул угљен-диоксида (ЦО2) представља линеарну геометрију, пошто угљеник, који је централни атом, нема на располагању пар упарених електрона. Угао између спојева је 180º.
О=Ц=О
Гас метан (ЦХ4) је један од гасова који доприносе глобалном загревању. То је најједноставнији угљоводоник, који се производи, на пример, у разградњи органске материје и у процесу варења неких биљоједа.
Геометрија молекула ЦХ4 тетраедаран је. Гас метан је једињење формирано од 5 атома и угљеника, који је централни атом, садржи 4 лиганда. Угао који омогућава највеће растојање између његових оса је 109º28’.
Алотропија је способност хемијског елемента да формира различите једноставне супстанце. Кисеоник, на пример, има два алотропа: гас кисеоника (О2), неопходан за аеробна бића, и озон (О3), који штити планету од ултраљубичастих зрака са Сунца.
Молекули формирани од два атома (дијатомски) имају линеарну геометрију. Триатомски молекули могу бити линеарни или угаони.
У случају озона (О3), геометрија је угаона јер централни атом садржи расположиви невезујући електронски пар.
(Уеспи) Повежите леву колону са десном колоном, повезујући хемијску врсту са њеном одговарајућом молекуларном геометријом, и означите тачан низ, од врха до дна:
САМО3 представља планарну тригоналну геометрију, јер централни атом сумпора (С) садржи 3 лиганда.
ПЦл5 представља тригоналну бипирамидну геометрију, пошто централни атом фосфора (П) садржи 5 лиганада.
Х2О он представља угаону геометрију, пошто централни атом кисеоника (О) садржи 2 лиганда и доступне упарене електронске парове.
НХ4+ има тетраедарску геометрију, пошто централни атом азота (Н) садржи 4 лиганда.
ЦО2 представља линеарну геометрију, јер централни атом угљеника (Ц) садржи 2 лиганда и нема доступних парова електрона.
(УФРГС) Сумпор диоксид, у контакту са ваздухом, формира сумпор триоксид који, заузврат, у контакту са водом, формира сумпорну киселину.
У левој колони, испод, наведено је 5 супстанци укључених у овај процес. У десној колони карактеристике молекула те супстанце.
Х2САМО4: тетраедарска геометрија и поларни молекул
САМО2: угаона геометрија и поларни молекул, као и молекул од Х2О
О2: линеарна геометрија и неполарни молекул
САМО3: тригонална геометрија и неполарни молекул
Молекули формирани од врсте хемијског елемента, као што је кисеоник (О2) су неполарни јер не показују разлику у електронегативности између својих компоненти.
Када постоји разлика у електронегативности између атома, геометрија одређује да ли је молекул поларни или неполарни.
На пример, сумпор триоксид (СО3) је неполарна због тригоналне геометрије која чини резултујући диполни момент молекула једнаким нули. С друге стране, сумпор диоксид (СО2) својом угаоном геометријом чини молекул поларним јер је вектор диполног момента различит од нуле.
(Уфес) Молекул ОФ2 је поларна, а молекул БеФ2 неполарно је. Ово је због (за):
а) ПОГРЕШНО. Када постоји разлика у електронегативности у молекулима, оно што одређује поларитет је геометрија.
б) ТАЧНО. Као кисеоник дифлуорид (ОФ2) има неспарене парове електрона, формира се угаона структура и резултујући диполни момент је различит од нуле, што га карактерише као поларни молекул.
У берилијум дифлуориду (БеФ2), централни атом нема неспарене електроне и, стога, његова геометрија је линеарна, чинећи диполни момент једнак нули, а молекул неполарним.
в) ПОГРЕШНО. Величина атома утиче на просторну структуру молекула.
г) ПОГРЕШНО. Реактивност је повезана са способношћу стварања веза.
д) ПОГРЕШНО. У ствари, поларитет молекула утиче на многа својства, укључујући тачку кључања (прелазак у гасовито стање).
БАТИСТА, Каролина. Вежбе из молекуларне геометрије (са коментарисаним шаблоном).Алл Маттер, [н.д.]. Доступна у: https://www.todamateria.com.br/geometria-molecular-exercicios/. Приступ на: