Главне неорганске функције су: киселине, базе, соли и оксиди.
Неорганска једињења имају различита својства и присутна су у многим ситуацијама у нашем свакодневном животу. Из тог разлога, о овој теми се много расправља на пријемним испитима, у Енем-у и на такмичењима.
Да бисмо вам помогли да се припремите за испите, направили смо ову листу 15 питања са коментарисаним резолуцијама и различитим приступима за сваку неорганску функцију.
Општи појмови
1. (ФГВ) Када се нека једињења раствори у води, стварају водени раствор који проводи електричну енергију. Од доле наведених једињења:
| И. У2САМО4 |
| ИИ. О.2 |
| ИИИ. Ц12Х.22О.11 |
| ИВ КНО3 |
| В. ЦХ3ЦООХ |
| ТЕСТЕРА. НаЦл |
Они формирају водени раствор који проводи електричну енергију:
а) само И, ИВ и ВИ
б) само И, ИВ, В и ВИ
в) сви
г) само ја и ВИ
д) само тестера
Тачна алтернатива: б) само И, ИВ, В и ВИ.
Кондукција електричне енергије у раствору настаје услед стварања електрично наелектрисаних врста, јона, како је Архениус пронашао у својим експериментима.
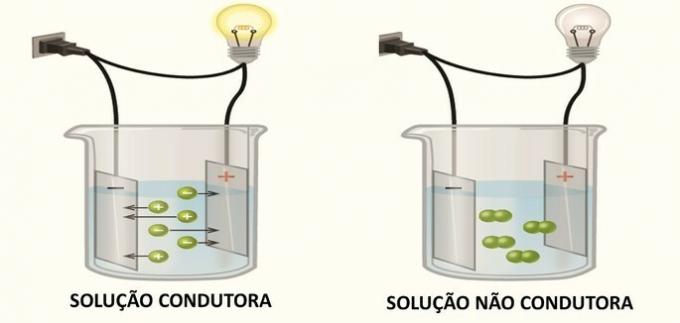
Када се јони формирају у раствору, катиони (позитивно наелектрисање) мигрирају на негативни пол и анионе (негативни набој) мигрирају на позитивни пол, затварајући електрични круг и омогућавајући пролазак кроз ланац.
Једињења која у раствору генеришу неутралне врсте не проводе електричну енергију.
Према овим информацијама морамо:
И. ПОГОН
У раствору, сол се дисоцира и настају јони.
ИИ. НЕ ВОЗИ
Двоатомни кисеоник на собној температури је инертан молекул.
ИИИ. НЕ ВОЗИ
Представљена формула је за сахарозу, молекуларно једињење које се, када дође у контакт са водом, молекули разиђу, али не губе свој идентитет.
ИВ ПОГОН
У раствору, сол се дисоцира и настају јони.
В. ПОГОН
Сирћетна киселина је слаба киселина која има мали јонизовани део у раствору.
ТЕСТЕРА. ПОГОН
У раствору, сол се дисоцира и настају јони.
2. (Мацкензие-СП)
Горња једначина представља реакцију
а) јонске дисоцијације.
б) која као реактант има киселину са киселином.
ц) укупне јонизације, формирајући хидроксонијумски катион.
д) јонизације, стварајући фосфидни анион.
д) која при пуној јонизацији производи моновалентни анион.
Тачна алтернатива: в) укупне јонизације, формирајући хидроксонијумски катион.
Фосфорна киселина је хемијско једињење које у контакту са водом јонизује и ослобађа Х јоне+.
Јонизација се одвија у три корака:
| Први корак | |
| Друга фаза | |
| трећи корак | |
| збир корака |
Катиони (Х.+) ослобођена реакција са водом, формирајући хидроксонски јон (Х3О.+).
Према овом резоновању, морамо:
а) ПОГРЕШНО. До дисоцијације долази у јонским једињењима, а фосфорна киселина је молекуларно једињење.
б) ПОГРЕШНО. Фосфорна киселина је триацидна киселина јер има три водоника која се могу јонизовати.
в) ТАЧНО. Катион хидроксонијума, који се назива и хидронијум, је врста настала спајањем јонизујућег водоника са водом.
г) ПОГРЕШНО. Произведени анион је фосфат (). Формула фосфида је:
е) ПОГРЕШНО. Настали анион () је тровалентна јер има 3 наелектрисања.
3. Тачно повезати доленаведена једињења са њиховим неорганским функцијама.
| И. ХБр, Х.3ДУСТ4 и Х.2ЦО3 | () киселине |
| ИИ. ЦО2, САМО2 и Ал2О.3 | () базе |
| ИИИ. Ал2(ОХ)3, КОХ и НХ4ох | () соли |
| ИВ НаЦℓ, КНО3 и БаСО4 | () оксиди |
Киселине су једињења која имају водонике који се јонизују.
(Ја) киселине: ХБр, Х.3ДУСТ4 и Х.2ЦО3
Базе имају хидроксил јон.
(ИИИ) базе: Ал2(ОХ)3, КОХ и НХ4ох
Соли су јонска једињења настала катионима и анионима.
(ИВ) соли: НаЦℓ, КНО3 и БаСО4
Оксиди су једињења настала спајањем кисеоника са другим елементима, осим са флуором.
(ИИ) оксиди: ЦО2, САМО2 и Ал2О.3
Киселине
4. Напишите име следећих киселина:
а) ХЦл и ХБр
Хлороводонична киселина и бромоводонична киселина.
Горња једињења представљају хидрате. Киселине у овој класи имају формулу Х.ИксА, где к представља број водоника (Х), а А одговара везаном металу.
Номенклатура ових супстанци се врши на следећи начин:
| Х. | Кл | |
| Киселина | Хлор | хидриц |
| Хлороводонична киселина |
| Х. | бр | |
| Киселина | Бром | хидриц |
| бромоводична киселина |
б) ХНО3 и ХНО2
Азотна киселина и азотна киселина.
Горња једињења представљају оксиакиселине са два оксидациона броја. Киселине у овој класи имају формулу Х.ИксАО, настаје од водоника, неметала и кисеоника.
Номенклатура ових супстанци се врши на следећи начин:
| Х. | Н. | О.3 |
| Киселина | Нитр | ицх |
| Азотна киселина. Садржај азота у овом једињењу је +5. |
Најниже једињење Нок је азотна киселина: ХНО2.
| Х. | Н. | О.2 |
| Киселина | Нитр | кост |
| Азотна киселина. Садржај азота у овом једињењу је +3. |
ц) ХЦлО, ХЦлО2, ХЦлО3 и ХЦлО4
Хлороводоничне, хлороводоничне, хлороводоничне и хлороводоничне киселине.
Горња једињења представљају оксиакиселине са четири оксидациона броја. Киселине у овој класи имају формулу Х.ИксАО, настаје од водоника, кисеоника и неметала из породице 7А.
Номенклатура ових супстанци се врши на следећи начин:
| Нок +1 | Киселина | нилски коњ | префикс елемента | кост |
| Нок +3 | Киселина | - | префикс елемента | кост |
| Нок +5 | Киселина | - | префикс елемента | ицх |
| Нок +7 | Киселина | пер | префикс елемента | ицх |
Једињења дата у алтернативи названа су како следи:
| Х. | Кл | О. | |
| Киселина | нилски коњ | хлор | кост |
| Хлороводонична киселина. Садржај хлора у овом једињењу је +1. |
| Х. | Кл | О.2 |
| Киселина | хлор | кост |
| Хлорна киселина. Садржај хлора у овом једињењу је +3. |
| Х. | Кл | О.3 |
| Киселина | хлор | ицх |
| Хлорова киселина. Садржај хлора у овом једињењу је +5. |
| Х. | Кл | О.4 | |
| Киселина | пер | хлор | ицх |
| Перхлорна киселина. Садржај хлора у овом једињењу је +7. |
5. (УВА-ЦЕ) ХЦлО киселине4, Х2МнО4, Х3ДУСТ3, Х4Субота2О.7, у погледу броја јонизирајућих водоника, можемо класификовати у:
а) монокиселина, дијакиселина, трикиселина, тетракиселина.
б) моноацид, диацид, триацид, триацид.
в) монокиселина, дијакиселина, дијакиселина, тетракиселина.
г) монокиселина, монокиселина, дијакиселина, трикиселина.
Тачна алтернатива: в) монокиселина, дијакиселина, дијакиселина, тетракиселина.
Јонизација представљених киселина се одвија на следећи начин:
Структурне формуле показују нам да су водоникови који се јонизују повезани са кисеоником.
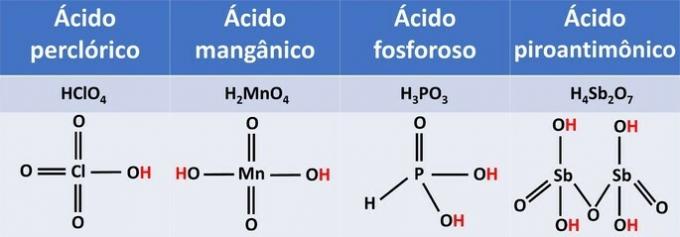
По количини водоника који се јонизују, киселине се могу класификовати у:
| ХЦлО4 | јонизујући водоник | моноацид |
| Х.2МнО4 | Два водоника која се јонизују | диацид |
| Х.3ДУСТ3 | Два водоника која се јонизују | диацид |
| Х.4Субота2О.7 | Четири водонична водоника | тетрацид |
За оксиакиселине, јонизујући водоници су они који су директно везани за кисеоник. Фосфорна киселина има један од своја три водоника везана за централни елемент, фосфор, и стога је дијакиселина.
6. (УЕСПИ) Нека киселине буду доле наведене, са одговарајућим степеном јонизације у процентима (α%):
|
ХЦлО4 (α% = 97%) |
Х.2САМО4 (α% = 61%) |
Х.3БО3 (α% = 0,025%) |
Х.3ДУСТ4 (α% = 27%) |
ХНО3 (α% = 92%) |
Проверите тачну изјаву:
Ах3ДУСТ4 је јачи од Х.2САМО4.
б) ХНО3 то је блага киселина.
ц) ХЦлО4 је слабији од ХНО3.
д) Х.3ДУСТ4 то је јака киселина.
е) Х.3БО3 то је слаба киселина.
Тачна алтернатива: е) Х.3БО3 то је слаба киселина.
Вредност одговара степену јонизације и израчунава се према:
Што је већа вредност , јача је киселина, јер то значи да је више јонизованих врста пуштено у раствор.
Према овом резоновању, морамо:
а) ПОГРЕШНО. Што је већа вредност , јача је киселина. Х2САМО4 има виши степен јонизације од Х.3ДУСТ4.
б) ПОГРЕШНО. ХНО3 има степен јонизације већи од 90%. Јака је киселина.
в) ПОГРЕШНО.4 има виши степен јонизације од ХНО3 будући да је, дакле, јачи од њега.
г) ПОГРЕШНО. Х3ДУСТ4 то је умерена киселина, јер има степен јонизације између 5% и 50%.
е) ТАЧНО. Х3БО3 има степен јонизације мањи од 5% и због тога је слаба киселина.
Базе
7. Унесите име следећих основа:
а) ЛиОХ и Бе (ОХ)2
Литијум хидроксид и берилијум хидроксид.
Приказане основе имају фиксну наелектрисаност и стога је номенклатура састављена на следећи начин:
ЛиОХ: литијум хидроксид.
Буди (ОХ)2: берилијум хидроксид.
б) ЦуОХ и Цу (ОХ)2
Купров хидроксид и бакарни хидроксид.
Бакар има два оксидациона броја: +1 и +2. Један од начина именовања променљиве нок база је следећи:
| Нок +1 | ЦуОХ | бакрени хидроксид |
| Нок +2 | Цу (ОХ)2 | бакарни хидроксид |
ц) Сн (ОХ)2 и Сн (ОХ)4
Лимен (ИИ) хидроксид и калај (ИВ) хидроксид.
Лим има два оксидациона броја: +2 и +4. Номенклатура променљиве базе нок такође се може урадити на следећи начин:
| Нок +2 | Сн (ОХ)2 | Калајни хидроксид ИИ |
| Нок +4 | Сн (ОХ)4 | Калајни хидроксид ИВ |
8. (Фиам-СП) За борбу против киселости стомака изазване вишком хлороводоничне киселине, уобичајено је да се уноси антацид. Од супстанци у наставку, које се налазе у свакодневном животу људи, најпогодније за борбу против киселости су:
сок.
б) сок од поморанџе.
в) вода са лимуном.
г) сирће.
д) магнезијево млеко.
Тачна алтернатива: е) магнезијево млеко.
Антациди су супстанце које се користе за подизање пХ желуца, јер вишак хлороводоничне киселине изазива смањење пХ и, сходно томе, повећање киселости.
За борбу против киселости у стомаку препоручује се унос а супстанца са основним карактером, јер ће приликом реакције са желучаном киселином произвести неутрализујућу реакцију, формирајући сол и воду.
Према овом резоновању, морамо:
а) ПОГРЕШНО. Сода се не може користити, јер у свом саставу садржи угљену киселину.
б) ПОГРЕШНО. Поморанџа се не може користити, јер у свом саставу садржи лимунску киселину.
в) ПОГРЕШНО. Лимун се не може користити, јер у свом саставу садржи лимунску киселину.
г) ПОГРЕШНО. Сирће се не може користити, јер у свом саставу садржи сирћетну киселину.
е) ТАЧНО. Треба користити магнезијево млеко, јер у свом саставу садржи базу магнезијум хидроксида.
Настала реакција неутрализације је:
9. (Осец) Јака база мора да се везала за ОХ групу-:
а) врло електропозитиван елемент.
б) врло електронегативни елемент.
в) полуметал.
г) метал који даје 3 електрона.
д) неметал.
Тачна алтернатива: а) врло електропозитиван елемент.
Јака база је она која има висок степен дисоцијације, односно слободних хидроксилних јона у раствору.
Хидроксилни јон има негативан набој, јер успева да привуче електрон себи када се дисоцира због електронегативности кисеоника.
Дакле, врло електропозитивни елемент има способност да губи електроне и предаје их хидроксилу, остајући у катионном облику у раствору.
а) ТАЧНО. Веома електропозитивни елементи попут алкалних метала и земноалкалијских метала чине јаке базе.
б) ПОГРЕШНО. Елемент електронегативнији од кисеоника изазвао би надметање за електрон.
в) ПОГРЕШНО. Полуметал има велику електронегативност.
г) ПОГРЕШНО. Хидроксилни јон има 1 наелектрисање. метал који даје 3 електрона формирао би базу са 3 хидроксила.
Пример:
е) ПОГРЕШНО. Најјаче базе су базе настале металима.
соли
10. Напишите име следећих соли:
а-Н-А2ЦО3
Натријум карбонат.
Ово је врста неутралне соли и њена номенклатура је дата на следећи начин:
| анион | катион |
| У+ | |
| карбонат | натријум |
| Натријум карбонат |
б) КНаСО4
Натријум и калијум сулфат.
Ово је врста двоструке соли и њена номенклатура је иста као и неутрална, а написана су имена два катиона.
| анион | катиони | |
| К.+ | У+ | |
| Сулфате | калијума | натријум |
| Натријум и калијум сулфат |
ц) НаХЦО3
Натријум монохидроген карбонат.
Ово је врста киселе соли и њена номенклатура је дата на следећи начин:
| Број водоника | анион | катион |
| 1 | У+ | |
| Моно | карбонат | натријум |
| Натријум монохидроген карбонат |
Популарно име овог једињења је натријум бикарбонат.
д) Ал (ОХ)2Кл
Алуминијум дихидроксихлорид.
Ово је врста основне соли и номенклатура је дата на следећи начин:
| Број хидроксила | анион | катион |
| 2 | Кл- | Ал3+ |
| Ди | хлорид | алуминијум |
| Алуминијум дихидроксихлорид |
Ово једињење је такође познато као двобазни алуминијум-хлорид.
е) ЦуСО4. 5 сати2О.
Бакар сулфат пентахидрат.
Ово је врста хидратисане соли и њена номенклатура је дата на следећи начин:
| анион | катион | број молекула воде |
| Асс2+ | 5 | |
| Сулфате | бакар | пента |
| Бакар сулфат пентахидрат |
11. (Унирио) Соли су такође производи добијени реакцијом потпуне или делимичне неутрализације јонизирајућих водоника киселина са базама или хидроксидима, према генеричкој реакцији:
Киселина + база Сол + вода
На основу те изјаве, која је једина киселина која нема све сродне могуће производе?
а) хлороводонична киселина производи само неутралну хлоридну со.
б) азот производи само нитрат неутралну со.
в) фосфор производи само неутралну фосфатну сол.
д) сулфид може да произведе или неутралну сулфидну сол или киселу со, кисели сулфид или водоник-сулфид.
е) сумпор може да произведе или неутралну сулфатну сол или киселу со, кисели сулфат или хидроген сулфат.
Нетачна алтернатива: ц) фосфор производи само неутралну фосфатну со.
а) ТАЧНО. Хлороводонична киселина има само један јонизујући водоник, који ће реаговати и формирати воду. Сол ће тада формирати анион киселине, у овом случају хлорид, и катион базе.
Примери:
б) ТАЧНО. Азотна киселина има само један јонизујући водоник, који ће реаговати и формирати воду. Сол ће тада формирати анион киселине, у овом случају нитрат, и катион базе.
Примери:
в) ПОГРЕШНО. Фосфорна киселина има три водоника која се могу јонизовати и зато може бити подвргнута делимичној или потпуној јонизацији. У овом случају могу се формирати три врсте соли:
- Укупна неутрализација која генерише а неутрална сол:
- Генерисање делимичне неутрализације а киселе соли:
- Генерисање делимичне неутрализације а основна со:
г) ТАЧНО. У тоталној неутрализацији настаје неутрална со, а у делимичној неутрализацији кисела со.
- Укупна неутрализација:
- Делимична неутрализација:
е) ТАЧНО. У тоталној неутрализацији настаје неутрална со, а у делимичној неутрализацији кисела со.
- Укупна неутрализација:
- Делимична неутрализација:
| И. У2Б.4О.7.10х2О. | ТХЕ. основна со |
| ИИ. Мг (ОХ) Цл | Б. двострука сол |
| ИИИ. НаКСО4 | Ц. киселе соли |
| ИВ НаХЦО3 | Д. хидратисана сол |
Тачна повезаност између њих је:
а) АИ, БИИИ, ЦИВ, ДИИ
б) АИИ, БИВ, ЦИИИ, ДИ
в) АИ, БИИ, ЦИИИ, ДИВ
д) АИИ, БИИИ, ЦИВ, ДИ
Тачна алтернатива: д) АИИ, БИИИ, ЦИВ, ДИ
| АИИ. базна со: Мг (ОХ) Цл | У својој структури има хидроксил. |
| БИИИ. двострука со: НаКСО4 | У својој структури има два метална катиона. |
| ЦИВ. кисела сол: НаХЦО3 | У својој структури има водоник. |
| ДИ. хидрирана со: На2Б.4О.7.10х2О. | У својој структури има молекуле воде. |
Оксиди
13. Напишите име следећих оксида:
челика2 и без2О.3
Угљен диоксид и душиков триоксид.
Ови оксиди су молекуларни оксиди, јер је кисеоник везан за неметале. Номенклатура за ову класу урађена је на следећи начин:
| број кисеоника | Број угљеника |
| 2 | 1 |
| Монокарбон диоксид или угљен диоксид |
| број кисеоника | Број азота |
| 3 | 2 |
| динитроген триоксид |
б) Ал2О.3 и на2О.
Алуминијум оксид и натријум оксид.
Ови оксиди су јонски оксиди, јер је кисеоник везан за метале. Метали везани за кисеоник имају фиксно наелектрисање. Стога се номенклатура за ову класу врши на следећи начин:
Ал2О.3: алуминијум оксид
У2О: натријум оксид
б) Цу2О и ЦуО
Бакров оксид И и бакарни оксид ИИ.
Ови оксиди су јонски оксиди јер је кисеоник везан за метал. Метал везан за кисеоник има променљиво пуњење. Један од начина именовања ове класе је следећи:
| Нок +1 | Асс2О. | бакар оксид И. |
| Нок +2 | ЦуО | бакар оксид ИИ |
в) ФеО и Фе2О.3
Жељезни оксид и железов оксид.
Ови оксиди су јонски оксиди јер је кисеоник везан за метал. Метал везан за кисеоник има променљиво пуњење. Номенклатура променљивог нокс оксида такође се може извршити на следећи начин:
| Нок +2 | ФеО | железов оксид |
| Нок +3 | Вера2О.3 | железов оксид |
14. (УЕМА) Неутрални атоми одређеног репрезентативног елемента М имају два електрона у својој валентној љусци. Тачне формуле за ваш нормални оксид и бромид су:
(Подаци: О = 6А и Бр = 7А.)
сам2О и МБр
б) МО2 и МБр2
в) МО и МБр2
д) М.2О.2 у2бр
у2О и МБр2
Тачна алтернатива: ц) МО и МБр2
М елементи имају два електрона у валентној љусци. Да би се повезао са другим елементима може изгубити ова два електрона и формирати М катион.2+.
Кисеоник припада породици 6А и потребна су му још 2 електрона да би стекли стабилност помоћу електронске конфигурације племенитог гаса, како је наведено у правилу октета.
Исто тако, брому, који је из породице 7А, потребан је само 1 електрон да би имао 8 електрона у валентној љусци.
Према овим информацијама морамо:
а) ПОГРЕШНО. Да се формира једињење М.2О и МБр, М елемент треба да формира М катион+.
б) ПОГРЕШНО. Кисеоник има 2-, а не 1- пуњење како је представљено приликом формирања МО једињења2.
в) ТАЧНО. Према валенцији јона, алтернатива је тачна.
г) ПОГРЕШНО. Бромид има 1-, а не 2-наелектрисање, као што је приказано приликом формирања једињења М.2Бр.
е) ПОГРЕШНО. Катион елемента има 2+ пуњења, а не 1+ пуњења, као што је приказано приликом формирања М једињења.2О.
15. (ПУЦ-МГ) Посматрајте хемијске реакције испод:
| И. МгО + Х.2О. |
| ИИ. ЦО2 + Х2О. |
| ИИИ. К.2О + 2ХЦл |
| ИВ САМО3 + 2НаОХ |
Нетачна изјава је:
а) Реакције ИИ и ИВ укључују киселе оксиде или анхидриде.
б) Реакције И и ИИИ укључују основне оксиде.
в) Сол произведена у реакцији ИВ назива се натријум сулфат.
г) Сол произведена у реакцији ИИИ назива се калијум хлорид.
е) Основни карактер оксида је наглашен како се кисеоник везује за више електронегативних елемената.
Нетачна алтернатива: е) Основни карактер оксида је наглашен док се кисеоник веже за више електронегативних елемената.
а) ТАЧНО. Када кисели оксиди попут угљен-диоксида и сумпор-триоксида реагују са водом, формирају киселину у раствору.
б) ТАЧНО. Када реагују са водом, основни оксиди као што су магнезијум оксид и калијум оксид чине базу у раствору.
в) ТАЧНО. У2САМО4 је формула за натријум сулфат.
г) ТАЧНО. КЦл је формула за калијум хлорид.
е) ПОГРЕШНО. Основни карактер оксида је наглашен како се кисеоник веже за више елемената. електропозитивна, као алкални и земноалкални метали, јер када реагују са водом стварају јаке базе, а када реагују са киселинама формирају сол и воду.