ТХЕ растворљивостможе се дефинисати као максимална могућа количина растворене супстанце која се може растворити у одређеној количини растварача на датој температури.
Ова максимална количина која се може растворити је такође позната као коефицијент растворљивости или степен растворљивости. Али растворљивост било које супстанце зависи, између осталог, од врсте растварача у којем је растворена супстанца распршена.
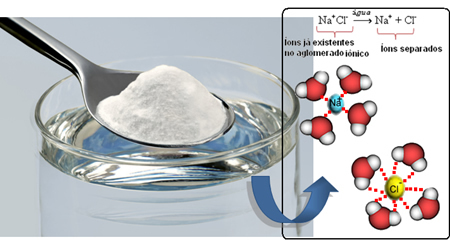
На пример, НаЦл (натријум хлорид - кухињска со) је веома растворљив у води, ау 1 Л воде на 20ºЦ можемо растворити до 360 грама ове соли. Али када се растварач промени у бензин, под истим условима запремине, температуре и притиска, со се не раствара.
Зашто растворљивост супстанце толико варира од једног растварача до другог?
Један од фактора је поларитет укључених једињења. У наведеном примеру имамо да је со је поларна, вода је поларна, а бензин је неполаран. Сол се формира од атома натријума (На) и хлора (Цл) који се везују преко јонских веза, у којима натријум дефинитивно донира електрон хлору, формирајући На ионе
+ и Цл-. Пошто ови јони имају супротна наелектрисања, они се привлаче и држе заједно (На+Цл-).
Ово нам показује да је со заиста поларна, свака јонска веза је поларна, јер постоји разлика у електричном набоју у једињењу.
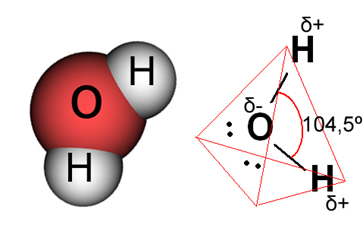
У случају воде, постојећа веза је ковалентна, у којој два атома водоника деле електроне са атомом кисеоника. Молекул воде има два дипола, при чему кисеоник има делимично негативно наелектрисање и водоник који има делимично позитиван набој (δ- О ─ Х δ+). Али, ови диполи се међусобно не поништавају, јер се молекул воде сусреће под углом од 104,5º, што показује да расподела и наелектрисање дуж молекула нису равномерни. На атому кисеоника у молекулу постоји већа густина негативног наелектрисања. Ово нам показује да је молекул воде заиста поларни.
Дакле, када умешамо со у воду, позитивни део соли, а то су На катјони.+, привлачи негативни део воде, а то је кисеоник, и негативни део соли (Цл ањони-) привлачи позитивни део воде (Х+). Сходно томе, синдикат На+Цл- разбија се, растварајући со у води.
Бензин, пак, настаје мешавином различитих угљоводоника, који су неполарни, односно расподела електричног наелектрисања бензина је равномерна. Дакле, нема интеракције јона соли са бензином и он се не раствара.
Ови и други слични случајеви нас наводе на следећи закључак:

Међутим, ово се не може сматрати општим правилом, јер постоји много случајева неполарних растворених материја које се добро растварају у поларним растварачима и обрнуто. Дакле, да бисмо разумели зашто се то дешава, морамо узети у обзир још један фактор: врсту интермолекуларна сила растварача и растворене супстанце.
Закон о томе у тексту: „Веза између међумолекулске чврстоће и растворљивости супстанци”.
Аутор: Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил школа - https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm
