Молекула је стабилно груписање два или више атома, истих или различитих, спојених ковалентним везама.
Молекуларна једињења су класификована према поларитету.
- Аполарни молекули: нема разлике у електронегативности између атома.
- Поларни молекули: постоји разлика у електронегативности између атома, са позитивним и негативним полом.
Када молекул формира више хемијских елемената, број електронских облака и лиганда централном атому одређује поларитет.
неполарни молекули
Молекули имају атоме повезане ковалентним везама, односно електрони се деле.
електронегативност то је способност атома да привуче електроне себи у везу, формирајући полове у молекулу.
Атом који привлачи електроне постаје негативни пол, акумулацијом негативног наелектрисања, а други атом постаје позитиван пол.
Када молекул чине атоми једног хемијског елемента, нема разлике у електронегативности, а молекул је аполате.

Молекули једноставних супстанци попут О.2 и без2, образују атома истог елемента; молекули композитних супстанци, с друге стране, имају најмање два различита елемента.

У молекула ЦО2 и БеХ2 они су такође неполарни због геометрије. Како оба имају линеарну геометрију, атоми на крајевима, кисеоник и водоник, привлаче електроне везе једни према другима, јер су електронегативнији.
Привлачење атома на левој страни уравнотежено је привлачношћу атома на десној страни. Како су везе исте, односно имају исти интензитет, али различите смерове, молекули не формирају полове.
поларни молекули
Када молекул формирају различити атоми, постоји разлика у електронегативности, али то је геометрија молекула која одређује да ли ће бити поларна или неполарна.

У оба примера видимо да централни атоми, кисеоник и азот, имају неспарене електронске парове који чине електронске облаке.
Будући да је око централног атома више електронских облака него што је за њега везаних једнаких атома, молекул је поларни.
Формирањем електронског облака, молекул поприма структуру која боље прилагођава атоме и због тога је геометрија воде угаона, а амонијак пирамидалан.
Желите да обогатите своје знање? Не пропустите доленаведене текстове!
- Биомолекуле
- Међумолекуларне снаге
- молекуларна формула
- Молекуларна маса
Вежбајте са коментарисаним повратним информацијама
1. Наведите поларитет молекула:

а) Аполар. Молекул се састоји од једног хемијског елемента, хлора. Како нема разлике у електронегативности, не формирају се полови.
б) Поларни. На централном елементу (С) су причвршћена 4 електронска облака и 2 једнака атома (Х).
в) Поларни. Постоје 3 облака електрона и 2 једнака атома (О) везана за централни елемент (С).
г) Поларни. Елементи молекула имају различите електронегативности. Негативни пол се формира у јоду због акумулације негативног наелектрисања и, последично, водонична страна ствара позитиван пол.
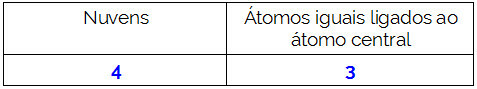
д) Поларни. За централни елемент (П) су причвршћена 4 електронска облака и 3 једнака атома (Цл).
ф) Поларни. На молекулу постоји асиметрична расподела наелектрисања, јер угљеник има различите лиганде.
г) Аполар. Молекул је двоатоман и састоји се од атома истог хемијског елемента, тако да нема разлике у електронегативности.
ж) Аполар. Број облака електрона једнак је броју атома прикачених за централни атом.
и) Аполар. Број облака електрона једнак је броју атома прикачених за централни атом.
2. (Фувест) Размотрите молекуле ХФ, ХЦл, Х.2О, Х.2, О.2 и ЦХ4.
а) Класификујте ове молекуле у две групе: поларне и неполарне.
| Поларни | аполар |
|---|---|
| Водоник-флуорид (ХФ) | Молекуларни водоник (Х.2) |
| Хлороводоник (ХЦл) | Молекуларни кисеоник (О2) |
| Вода (Х.2О) | Метан (ЦХ4) |
ХФ, ХЦл и Х.2Они су поларни, јер је у три једињења водоник везан за врло електронегативне елементе.
Х.2 то је2 они су неполарни, јер у молекулима нема разлике у електронегативности. ЦХ4 такође је неполаран јер је број облака електрона једнак броју елемената који су везани за централни атом, угљеник.
Својство које се односи на атом: електронегативност.
Молекули који настају од атома само једног хемијског елемента класификовани су као неполарни, јер нема разлике у електронегативности.
Својство повезано са молекулом: количина облака и број једнаких лиганада.
Молекули настали атомима различитих хемијских елемената класификовани су као поларни или неполарни према броју електронских облака и количини лиганда централном атому.
Вода је поларна, јер централни атом, кисеоник, има неспарени пар електрона, што узрокује 3 електронска облака и 2 лиганда. Због тога је расподела наелектрисања асиметрична, формирајући полове у молекулу.
Метан је неполаран, јер централни атом, угљеник, има број лиганда једнак броју електронских облака, чинећи геометрију тетраедарском и нема поларности у молекулу.
3. (Вунесп) Међу алтернативама у наставку наведите ону са нетачном изјавом:
а) Ковалентна веза је она која се јавља дељењем електрона између два атома.
б) Ковалентно једињење ХЦл је поларно, због разлике у електронегативности која постоји између атома водоника и хлора.
ц) Једињење настало између алкалног метала и халогена је ковалентно.
д) Супстанца формуле Бр2 неполаран је.
е) Супстанца формуле Цал2 то је јонски.
Нетачна алтернатива: ц) Једињење настало између алкалног метала и халогена је ковалентно.
а) ТАЧНО. Ова врста везе одговара дељењу електрона углавном између неметала.
б) ТАЧНО. Хлор има већу електронегативност од водоника и због тога привлачи пар електрона из везе ка себи, узрокујући неравнотежу наелектрисања.
Молекул ХЦл је поларни, јер се негативни пол ствара у хлору услед акумулације негативног наелектрисања и, сходно томе, водонична страна тежи да има акумулирани позитивни набој, чинећи пол позитивно.
ц) НЕПРАВИЛНО. Кроз јонске везе, метали су у стању да донирају електроне и да остану позитивно наелектрисани, формирајући катионе; халогени, с друге стране, примају електроне и формирају анионе, врсте са негативним наелектрисањем.
г) ТАЧНО. Молекул је двоатоман и састоји се од атома истог хемијског елемента, тако да нема разлике у електронегативности.
е) ТАЧНО. У јонској вези, електрони се донирају или примају од атома. У јонском једињењу калцијум дарује два електрона и формира катион Ца2+. Јод прима електроне из калцијума и формира негативно наелектрисану врсту, И.2-.
Обавезно проверите ове текстове о питањима везаним за тему овог садржаја:
- јонске везе
- ковалентне везе
- Поларитет веза
- Једноставне и сложене супстанце
- Општа својства материје