Да бисте разумели феномен јонизација прво је потребно знати шта су јони. Обратите пажњу на објашњење у наставку:
Сваки атом има једнак број протона и електрона; стога је сваки атом електрично неутралан. Даље, супстанце формиране од група атома такође имају вагу електричног набоја, будући да су електрично неутралне.
Међутим, атом или група атома могу изгубити или добити електроне; када се то догоди, они губе неутралност и постају јони.
Ако атом или група атома изгуби електроне, биће позитивно наелектрисани и биће јон који се зове катион. Међутим, ако добијете електроне, наелектрисање ће бити негативно, а јон ће бити а анион.
Неорганске супстанце су јонске или имају способност стварања јона.
Један од начина за стварање јона је постављање молекуларних супстанци у воду, односно насталих ковалентним везама, у којима се деле електрони.
На пример, ако тестирамо електричну проводљивост хлороводоничне киселине (ХЦл) у воденом раствору (хлороводоник) растворен у води), видећемо да је раствор електролитски, односно проводи електричну струју, јер у њему постоје јони решење.

То значи да је вода деловала као реактант, формирајући јоне из хлороводоничне киселине. Ово се дешава према реакцији испод:
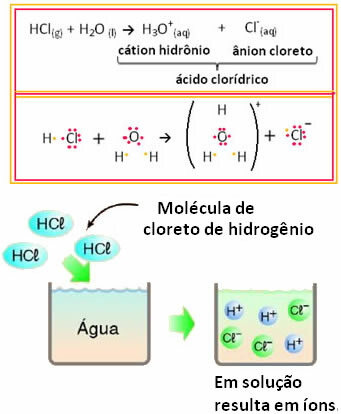
Имајте на уму да пре стављања водоник-хлорида у воду није било јона. Међутим, његови молекули су реаговали са водом и створили позитивне Х јоне3О.+ (катиони) и негативи Кл- (аниони). Пошто је хлор електронегативнији од водоника, он привлачи пар електрона из ковалентне везе близу себе и формира анион. С друге стране, водоник привлачи кисеоник у води, који је електронегативнији од хлора; а између водоника и кисеоника настаје ковалентна веза, која даје катион хидронијума. Ова појава стварања јона је тзвјонизација.
На основу горњег објашњења, јонизацију можемо дефинисати на следећи начин:

Имајте на уму да јони раније нису постојали, јер да јесу, као у случају растварања јонских једињења, имали бисмо јонску дисоцијацију, а не јонизацију.
Све киселине које су у контакту са водом пролазе јонизацију. Међутим, није свако молекуларно једињење јонизовано.На пример, шећер (Ц.12Х.22О.11) је молекуларан, међутим, када се стави у воду, не стварају се јони, он се само раствара, стварајући неелектролитички молекуларни раствор који не проводи електричну енергију.
Јеннифер Фогаца
Дипломирао хемију
