Тачка топљења и тачка кључања представљају температуру на којој супстанца мења стање под одређеним притиском.
У случају тачке топљења, супстанца прелази из чврстог у течно стање. Тачка кључања односи се на промену из течног у гасовито стање.
На пример, лед почиње да се претвара у воду у течном облику када је његова температура једнака 0 ° Ц. Дакле, тачка топљења воде је 0 ° Ц (под притиском од 1 атмосфере).
Да би прешла из течности у пару, вода мора достићи температуру од 100 ° Ц. Дакле, тачка кључања воде је 100 ° Ц (под притиском од 1 атмосфере).

Тачка фузије
Када супстанца у чврстом стању прими топлота, долази до повећања степена агитације његових молекула. Последично се и његова температура повећава.
По постизању одређене температуре (тачке топљења), молекули су узнемирени тако да прекидају унутрашње везе између атома и молекула.
У овом тренутку супстанца почиње да мења своје стање и прелази у течно стање ако настави да прима топлоту.
Током Фузија његова температура остаје константна, јер се примљена топлота користи искључиво за промену стања.

Зове се топлота по јединици масе потребна за промену фаза латентна топлота фузије (Л.ф) и карактеристика је супстанце.
Тачка топљења и табела латентне топлоте
У доњој табели означавамо температуру тачке топљења и латентну топлоту неких супстанци атмосферски притисак.
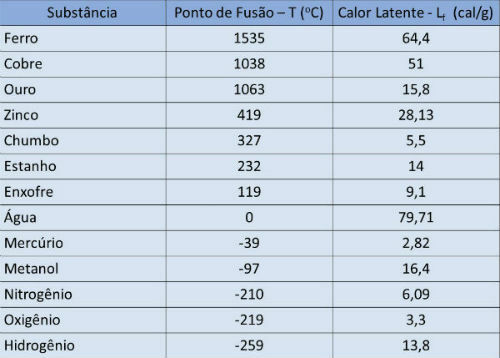
Тачка кључања
ТХЕ кипећи одликује се брзим преласком из течности у гасовито стање, уз стварање пара (мехурића) унутар течности.
Као и код фузије, постоји температура (тачка кључања) при којој се дата супстанца прелази из течног у гасовито стање.
Да би се ово догодило, супстанца мора да прими топлоту. Током целе фазне промене температура остаје константна.
латентна топлота од испаравање (Лв) је количина топлоте по јединици масе потребна да би супстанца променила фазу.
Тачка кључања и табела латентне топлоте
У доњој табели означавамо температуру тачке кључања и латентну топлоту испаравања неких супстанци под атмосферским притиском.
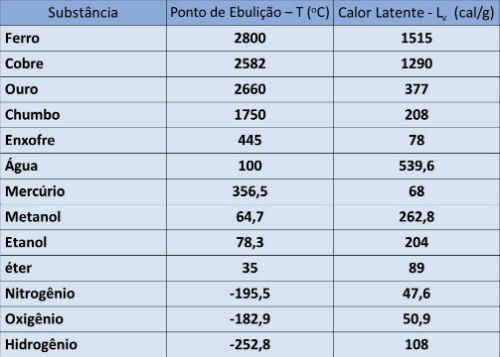
Сметње под притиском
Температура тачке топљења и тачке кључања зависе од притиска који се врши на супстанцу.
Генерално, супстанце се повећавају у запремини када се подвргну фузији. Ова чињеница значи да што је већи притисак, то је већа температура да супстанца промени своју фазу.
Изузетак се јавља код неких супстанци, укључујући воду, која смањује запремину топљењем. У овом случају, већи притисак ће смањити тачку топљења.

Смањење притиска доводи до ниже тачке кључања дате супстанце, што значи да ће супстанца кључати на нижој температури.
На пример, на местима изнад нивоа мора вода кључа на температурама испод 100 ° Ц. Као резултат, потребно је много дуже да се кува на овим местима него на местима на нивоу мора.
Прочитајте такође:
- Промене физичког стања
- Термометријске ваге
- Термометријске ваге - вежбе
- Физичка стања воде
- Дијаграм фаза
- Солидифицатион
- Кондензација
- Колигативна својства
- Периодична својства
- Испаравање
- Вежбе на периодном систему

