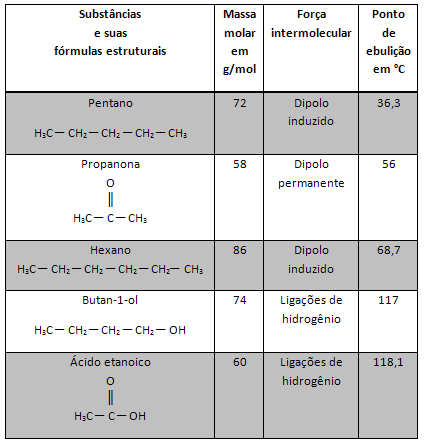
Raztopina je homogena zmes dveh ali več snovi.. Kot na primer raztopina soli (topljene snovi), raztopljene v vodi (topilo).

Ta postopek je zlasti v kemijskih laboratorijih in industriji zelo pomemben, ker mora kemik pripraviti raztopine z znanimi koncentracijami. Poleg tega se v eksperimentalnih dejavnostih uporabljajo raztopine z zelo nizkimi koncentracijami, zato se vzorec koncentrirane raztopine razredči do želene koncentracije.
Vsak dan večkrat, ne da bi se tega sploh zavedali, izvedemo postopek redčenja raztopin. Na primer embalaža izdelkov za čiščenje in higieno v gospodinjstvu, kot so razkužila, svetuje, da jih pred uporabo razredčite. Nekateri proizvajalci na etiketah izdelkov predlagajo, da se razredči z vodo v razmerju 1 do 3, to pomeni, da je treba za vsak del izdelka dodati 3 dele vode. To se naredi, ker je izdelek zelo koncentriran in močan in lahko poškoduje mesto, kjer ga bomo uporabili, če ga ne razredčimo na pravi način. Po drugi strani pa, če ga razredčite bolj, kot bi smeli, lahko izgubite denar, ker izdelek ne bo dosegel želenega rezultata.

Drug primer je, ko delamo sokove. Oznake številnih koncentratov sokov kažejo, da je treba kozarec soka razredčiti ali zmešati s 5 kozarci vode. Tako postane sok "šibkejši", torej manj koncentriran.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Predstavljajte si, da ste takšen sok razredčili v 3 L vode. Če je bila začetna koncentracija soka 40g / L, to pomeni, da je imel maso 40g za vsak liter topila. Ker pa bomo imeli 3 L, bomo maso delili s 3, koncentracija pa bo približno 13, 33 g / L ali 13 gramov za vsak liter raztopine. Vendar v celotni raztopini masa 40 g raztopljene snovi še vedno ostane.
Izračun te nove koncentracije se lahko izvede na naslednji način:
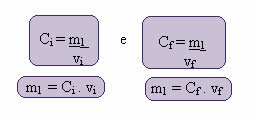
Kjer indeksa i in f predstavljata začetno in končno vrednost. Ker se vrednost m1 ni spremenila, lahko enačbe izenačimo:
Çjaz. vjaz = Cf. vf
Zamenjava vrednosti, ki jih imamo, po prejšnjem primeru upoštevajte:
Začetna rešitev:
Çjaz: 40g / l
m1: 40g
vjaz: 1L
Končna rešitev:
Çf: ?
m1: 40g
vf: 3L
Çjaz. vjaz = Cf. vf
(40 g / L). (1 L) = Cf. 3L
Çf = 40 g / L
3
Çf = 13,333 g / l
Enako razmišljanje velja tudi za molsko koncentracijo (M) in za masni odstotek topljene snovi ali titra (T):
Mjaz. vjaz = Mf. vf in Tjaz. vjaz = Tf. vf
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Brazilska šolska ekipa
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Razredčevanje raztopin"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. Dostop 27. junija 2021.