Ob medmolekularne sile, splošno imenovano Van der Waalsove sile, tam so drevesa: inducirani dipol, induciran dipol, vodikove vezi in trajni dipol-trajni dipol. V tem besedilu bomo upoštevali le zadnjo od teh treh sil:
Moč stalni dipol-trajni dipolali preprosto, dipol-dipol se pojavi le v polarne molekule, to je tistih, ki nimajo enakomerne porazdelitve obremenitve po svoji površini. Kot primer lahko navedemo, da je elektronski oblak v molekuli HCl (klorovodikov plin) bolj premaknjen proti atomu klora, saj je bolj elektronegativen kot vodik.
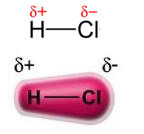
Upoštevajte, da se okoli atoma klora kopiči elektroni, kar povzroči nastanek a negativni pol, ki jo simbolizira grška črka delta (-δ). Posledično je v območju okoli vodikovega atoma a pozitivni pol (+δ), saj ima nizko elektronsko gostoto. Nato molekula HCl tvori a električni dipol in zato pri stiku z drugimi sosednjimi molekulami HCl obstaja privlačna sila med nasprotnima poloma molekul, kot je razvidno spodaj:
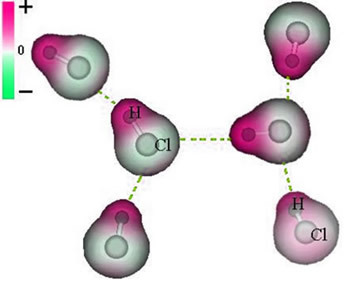
Ta privlačna sila, ki se vzpostavi med negativnim koncem dipola ene molekule in pozitivnim koncem dipola druge molekule, predstavlja dipol-dipolno silo..
Kot že ime pove, je dipol trajen, zato se pojavlja le v polarnih spojinah. In večja ko je polarnost molekule, bolj intenzivne so dipol-dipolne interakcije v snovi.
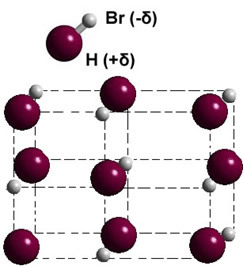
Če je v trdni fazi, tvorba trajnega dipola vodi položaj vsake molekule v prostoru, pri čemer nastane dipolarni kristali; kot v primeru vodikovega bromida, prikazanega spodaj:
Drugi primeri polarnih snovi, ki imajo dipol-dipolno moč med svojimi molekulami, so: H2S, CO, HCCl3, SAMO2.
Ta medmolekularna sila je srednje intenzivnosti, saj je močnejša od inducirane dipolno inducirane dipolne privlačne sile, vendar manj intenzivna od vodikove vezi. Zato so njihova tališča in vrelišča višja od tališč snovi, ki imajo inducirano dipolno trdnost. Ker je stalna dipolna sila močnejša, je treba zagotoviti več energije, da se interakcije njegovih molekul razgradijo.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm
