V každodennom živote a v laboratóriách existujú reakcie a premeny, ktoré sú spontánne, a iné, ktoré nie sú spontánne. Napríklad všetko spaľovanie je spontánna reakcia, pretože akonáhle sa spustí, bude pokračovať, kým sa nespotrebuje všetko palivo alebo kým nezmizne všetok kyslík.
Na druhej strane, elektrolýza je spontánny proces, pri ktorom sa elektrická energia transformuje na chemickú energiu. Príkladom je elektrolýza chloridu sodného (NaCl). Pri prechode elektrického prúdu cez túto roztavenú soľ dochádza k redoxným reakciám a tvorbe kovového sodíka (Nas) a plynný chlór (Cl2 písm. G)). Ak prestaneme napájať elektrický prúd, reakcia nebude pokračovať sama, čo ukazuje, že to nie je spontánne.
Spontánnosť reakcie možno merať pomocou Gibbs-Helmholtzova rovnica, dané nižšie:

Na čom:
∆G = variácia voľnej energie;
∆H = zmena entalpie;
T = teplota v Kelvinoch (vždy kladná);
∆S = zmena entropie.
Táto rovnica má svoj názov, pretože ju navrhol americký fyzik J. Willard Gibbs (1839-1903) a nemecký fyzik Hermann Helmholtz (1821-1894).
Aby sme lepšie pochopili, ako nám táto rovnica pomáha určiť spontánnosť reakcie, stručne si zopakujme každý z pojmov v nej zahrnutých:
- ∆H (zmena entalpie): Entalpia (H) je energetický obsah látky. Zatiaľ nie je známy žiadny spôsob, ako to určiť. V praxi sa dosiahne meranie odchýlky entalpie (∆H) procesu pomocou kalorimetrov. Táto variácia predstavuje množstvo energia, ktorá sa uvoľnila alebo absorbovala v procese.
- ∆S (zmena entropie):Entropia (S) je termodynamická veličina, ktorá meria stupeň poruchy v systéme.
Napríklad pri topení ľadu sa molekuly pohybujú z pevného do kvapalného skupenstva, kde dochádza k väčšej dezorganizácii. To znamená, že v tomto procese vzrástla entropia (∆S> 0).
Teraz neprestávajte... Po reklame je toho viac;)
Pri výrobe amoniaku (NH3), 1 mol plynného dusíka reaguje s 3 mol plynného vodíka (tj. 4 mol molekúl v reaktantoch), pričom vzniknú 2 mol amoniaku:
N2 písm. G) +3 H2 písm. G) → 2 NH3 (g)
Pretože sa v tomto procese znižuje počet molekúl v plynnej fáze, znížila sa dezorganizácia, čo znamená, že sa znížila aj entropia (∆S <0).
- ∆G (energia zadarmo): Energia zadarmo príp Gibbsova voľná energia (pretože to navrhol iba tento vedec v roku 1878) je užitočná energia systému, ktorý sa používa na vykonávanie práce.
Systém má globálnu energiu, ale iba zlomok tejto energie sa použije na prácu, toto sa nazýva Gibbsova voľná energia, ktorú symbolizuje G.
Podľa Gibbsa proces sa považuje za spontánny, ak vykonáva prácu, to znamená, ak klesá G. V tomto prípade bude konečný stav transformácie stabilnejší ako počiatočný stav, keď ∆G <0.
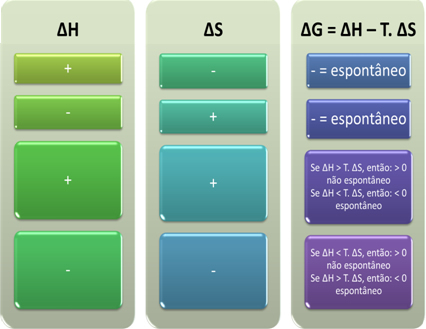
Na základe toho môžeme konštatovať nasledovné:

Môžeme tiež zistiť, či bude proces spontánny, keď sa pozrieme na algebraický znak ∆H a ∆S v Gibbsovej-Helmholtzovej rovnici:
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Gibbsova voľná energia“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm. Prístup k 28. júnu 2021.