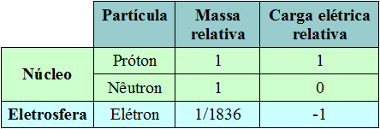
V roku 1926 to uviedol vedec Werner Heisenberg (1901-1976) nie je možné súčasne s veľkou presnosťou určiť rýchlosť a polohu elektrónu daného atómu. V skutočnosti je možné určiť polohu alebo rýchlosť elektrónu izolovane, ale ako sa zvyšuje presnosť určovania jedného, presnosť určovania druhého sa stráca. To znamená, že čím presnejšie je meranie polohy elektrónu v atóme, tým je meranie jeho rýchlosti pohybu menej presné a naopak.
Je ľahké určiť polohu a rýchlosť veľkého objektu, napríklad automobilu; elektrón je však mikroskopický, a preto nie je možné určiť jeho rýchlosť a polohu, pretože samotné meracie prístroje by tieto stanovenia pozmenili.
Bolo teda prijaté, že namiesto určenia iba definovanej obežnej dráhy pre elektrón je vhodnejšie a správnejšie pripustiť, že existujú regiónoch je možné, aby tento elektrón bol. Tieto oblasti, kde je pravdepodobnosť nájdenia elektrónu v atóme maximálna, boli povolaní orbitály.
Vedec Erwin Schrödinger vykonal výpočty na určenie tejto oblasti a prišiel s príslušnou rovnicou nasledujúce veličiny elektrónu: hmotnosť, energia, náboj a korpuskulárna podstata, to znamená jej podstata ako častica
*.Teraz neprestávajte... Po reklame je toho viac;)
Na základe výsledkov tejto rovnice bolo možné identifikovať elektróny podľa nich energetický obsahprostredníctvom svojich štyroch kvantové čísla (numerické riešenie rovnice). Tieto kvantové čísla sú: hlavné, sekundárne alebo azimutálne, magnetické a spinové.
Prostredníctvom týchto čísel teraz vieme, že elektróny sú usporiadané okolo atómového jadra (ako je znázornené na obrázku nižšie) a že každý elektrón má svoje príslušné kvantové čísla; neexistuje možnosť, aby dva elektróny v rovnakom atóme mali rovnaké kvantové čísla.

* Podľa francúzskeho fyzika Louisa De Broglieho má elektrón dvojitú charakteristiku, to znamená, že má chovanie časticových vĺn. Každý elektrón je tiež spojený s vlnou. V závislosti od toho, podľa uskutočňovanej štúdie, sa elektrón považuje za časticu alebo vlnu. V tomto prípade súvisela jej povaha ako častice.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Princíp Heisenbergovej neistoty“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/o-principio-incerteza-heisenberg.htm. Prístup k 28. júnu 2021.