Atómy sú nekonečne malé častice, ktoré tvoria všetku hmotu vo vesmíre. Časom sa predstava o tom, ako by vyzerala atómová štruktúra, zmenila podľa nových objavov vedcov. Viac sa o tom dozviete v texteVývoj atómového modelu.
Model je reprezentáciou reality (nie samotnej reality), takže atómové modely sú reprezentáciami hlavné zložky atómu a jeho štruktúru a vysvetliť určité fyzikálne a chemické správanie látky. To sa deje preto, lebo ľudská bytosť ešte nie je schopná vidieť izolovaný atóm ani pri ultramikroskopoch.
Ak chcete získať predstavu o tom, aký malý je atóm, vedzte to The Najmenšia častica viditeľná pod obyčajným mikroskopom obsahuje viac ako desať miliárd atómov! Atóm je taký malý, že, ak by sme ich dali milión vedľa seba, nedostali by sme sa na hrúbka vlasu.
Myšlienková mapa: Atom
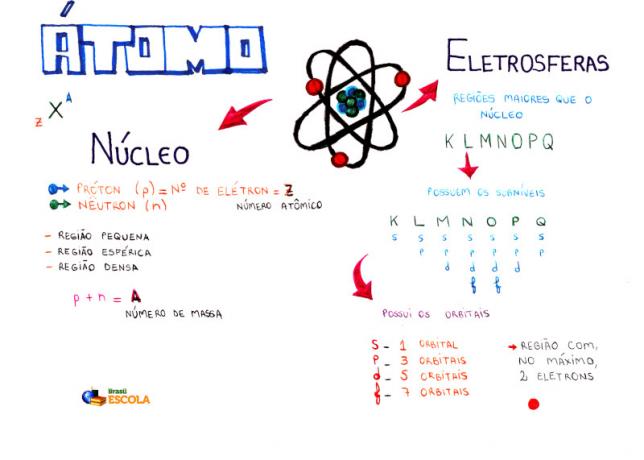
* Ak si chcete stiahnuť myšlienkovú mapu v PDF, Kliknite tu!
Spomedzi atómových modelov je v súčasnosti na strednej škole najpoužívanejšie na pochopenie štruktúry atómu a jeho vlastností Rutherford-Bohrov model. Podľa tohto modelu sa štruktúra atómu skladá z dvoch hlavných častí: jadro a elektrosféra.

Dve hlavné časti štruktúry atómu - elektroguľa a jadro
* Jadro: Predstavuje centrálnu časť atómu. Je kompaktný, masívny a veľmi hustý, navyše je tvorený časticami s väčšou hmotnosťou, ktoré sú protónmi a neutrónmi.

Ilustrácia protónov a neutrónov, ktoré tvoria atómové jadro
- Protóny: sú to častice s kladným elektrickým nábojom (relatívny náboj = +1; náboj v coulombe (C) = +1,602. 10-19) a jeho relatívna hmotnosť sa rovná 1.
Skutočnosť, že protóny tvoria jadro a dodávajú mu celkovo kladný náboj, objavila Eugen Goldstein, v roku 1886, prostredníctvom modifikácie Crookesovej ampulky a niektorých experimentov. Videl, že pri veľmi vysokom napätí sa objavujú emisie (anódové lúče - zvyšky atómov plynu, ktoré sa nachádzali vo vnútri žiarovky a ktorým boli elektróny vytrhnuté elektrickým výbojom). Umiestnením elektrického alebo magnetického poľa mimo žiarovku sa tieto lúče odklonili smerom k zápornému pólu. To znamenalo, že existovali pozitívne subatomárne častice, ktoré sa nazývali protóny.
Neskôr, Ernest Rutherford (1871-1937) uskutočnili experiment opísaný v texte Rutherfordov atóm, čo ho viedlo k objaveniu polohy protónu: v jadre.
- Neutróny: sú to častice s hmotnosťou rovnou hmotnosti protónov (1), ale ako už z názvu vyplýva, sú neutrálne, to znamená, že nemajú elektrický náboj.
Neutróny objavili v roku 1932 James Chadwick (1891-1974), ktorý si uvedomil, že jadro rádioaktívneho berýlia emitovalo neutrálne častice s hmotnosťou zhruba rovnakou ako hmotnosť protónov (v skutočnosti je o niečo väčšia).
Teraz neprestávajte... Po reklame je toho viac;)
Priemer jadra závisí od množstva protónov a neutrónov, ktoré atóm má, ale v priemere sa pohybuje okolo 10-14 mesiac a 10-15 m.
Atómové jadro koncentruje prakticky celú hmotnosť atómu, čo je veľmi malá časť: protón aj neutrón sú asi 100 000-krát menšie ako celý atóm samotný! Na porovnanie si predstavme, že zväčšíme jadro atómu prvku vodík (ktorý má iba protón) o veľkosti tenisovej loptičky, najbližší elektrón by bol vzdialený asi tri kilometre vzdialenosť! Aj keby bol atóm zväčšený na výšku 14-poschodovej budovy, jeho jadro by malo na siedmom poschodí veľkosť iba ako zrnko soli. Je to naozaj niečo úžasné, nemyslíte ?!
* Elektrosféra: Je oblasť, kde sa elektróny otáčajú okolo jadra. Napriek tomu, že je to oblasť oveľa väčšieho objemu ako jadro, je prakticky prázdna, pretože každý elektrón je 1836-krát menší ako 1 protón (alebo ako 1 neutrón). Preto je hmotnosť atómu prakticky celá v jadre. Elektróny sú častice so záporným elektrickým nábojom (-1).
Elektróny objavili v roku 1897 Joseph John Thomson (1856-1940), tvorca Thomsonov atómový model. Thomsonov experiment je možné podrobne vidieť v texte Thomsonov experiment s elektrickými výbojmi, ale skrátka použil spomínanú Crookesovu ampulku a uvedomil si, že katódové lúče vždy boli priťahoval kladný pól, čo dokazovalo, že atóm mal negatívne častice, ktoré sa nazývali elektróny.
Elektróny sa točia okolo jadra miliardy krát za milióntinu sekundy, formujú atóm a nechajú ho pôsobiť, akoby bol pevný.
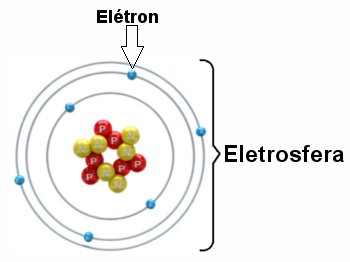
Ilustrácia elektrosféry s tromi elektronickými vrstvami a elektrónmi rotujúcimi okolo jadra.
Stručne, môžeme vytvoriť tabuľku na rozlíšenie troch hlavných subatomárnych častíc, ktoré sú súčasťou štruktúry atómu:

Hmotnosť a elektrický náboj troch hlavných subatomárnych častíc - protónov, neutrónov a elektrónov
Atómy všetkých chemických prvkov sú zložené z týchto troch subatomárnych častíc. To, čo sa líši od jedného chemického prvku od druhého, je množstvo, v ktorom sa tieto častice objavujú, najmä množstvo protónov v jadre, ktoré sa nazýva atómové číslo. Pokračujte v štúdiu prostredníctvom textu. Chemický prvok.
* Mind Map by Me. Diogo Lopes
Autor: Jennifer Fogaça
Vyštudoval chémiu
Chémia
Klasifikácia látok, voda, kyanovodíky, oxid uhličitý, amoniak, vodík, hélium, látky jednoduché, zložené látky, zmesi, fázy zmesi, homogénna zmes, zmes heterogénny.