K hydrogenácii dochádza u nenasýtených acyklických uhľovodíkov, to znamená, ktoré majú otvorené reťazce s dvojitými alebo trojitými väzbami, ako sú alkény, alkíny a diény. Môže sa vyskytovať aj v aromatických uhľovodíkoch, pretože majú dvojité väzby v kruhu, a v cyklánoch (cykloalkánoch) až s piatimi uhlíkmi.
Tieto zlúčeniny reagujú ako plynný vodík v prítomnosti určitého katalyzátora, ako je napríklad nikel, platina a paládium, pri zahrievaní. Nastáva teda adičná reakcia, pri ktorej sa väzba pi (π) rozbije, čím sa vytvoria dve nové jednoduché väzby a do molekuly sa zavedie vodík.
Spravidla máme:
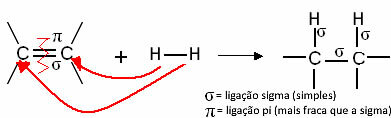
Všeobecná hydrogenačná reakcia
Teraz sa pozrime na niekoľko príkladov:
- Hydrogenácia na alkény: Získaným produktom je alkán.
Ďalej máme hydrogenačnú reakciu etylénu (alebo etylénu) na získanie etánu:
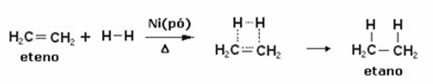
Príklad hydrogenačnej reakcie etylénu
Tento typ katalytickej hydrogenácie používa potravinársky priemysel na výrobu polotuhých tukov ako napr margaríny. Rastlinné oleje a tuky sa líšia iba tým, že majú dlhé molekuly s dvojitými väzbami medzi uhlíkmi, zatiaľ čo tuky majú medzi sebou iba jednoduché väzby uhlíky.
Teda na premenu oleja na tuk stačí olej hydrogenovať. Takto sa vaše dvojité väzby rozbijú a prevedú na jednoduché väzby. Výsledkom je produkcia hovorov hydrogenované rastlinné tuky.
- Alkyne hydrogenácia: Keďže alkíny majú dve väzby pí, dochádza k ich úplnej hydrogenácii v dvoch fázach, v prvom sa tvorí alkén a v druhom alkáne.
V nasledujúcej reakcii máme hydrogenáciu propínu s konečnou tvorbou propánu:
1. krok: H3C C ≡ CH + H2 → H3C CH═ ÇH2
2. etapa: H3C CH═ ÇH2 + 2 hodiny2 → H3C CH2─ ÇH3
Ak chceme, aby sa táto reakcia zastavila v 1. kroku, musíme použiť nejakú látku, ktorá zastaví pôsobenie katalyzátora.
- Hydrogenácia diénov: Existujú tri typy diénov: nahromadený (dvojité väzby sa objavia nižšie), izolovaný (dvojité väzby sú oddelené najmenej dvoma jednoduchými väzbami) a konjugáty (dvojité väzby sa objavujú striedavo).
K hydrogenácii nahromadených a izolovaných diénov dochádza rovnakým spôsobom, aký sme videli pre alkény, ale dvojnásobne, pretože diény majú viac nenasýtenosti. Pozrite si dva príklady:
* Príklad hydrogenácie v nahromadenom diéne:
H H H
│ │ │
H3C CH ═ Ç ═ CH ─ CH3 + 2 hodiny2 → H3C CH ─ Ç ─ CH ─ CH3
│ │ │
H H H
* Príklad hydrogenácie v izolovanom diéne:
H H H H
│ │ │ │
H3C CH ═ CH─CH2 ─ CH ═ CH ─ CH3 +2 H2 → H3C CH ─ CH─CH2 ─ CH ─ CH ─ CH3
Na druhej strane, k hydrogenácii konjugovaných diénov môže dôjsť dvoma spôsobmi: s prídavkom 1,2 a 1,4. Najbežnejšia je prísada 1,2, pri ktorej sa vodíky pridávajú k uhlíkom, ktoré vytvárajú dvojitú väzbu, a pri nízkych teplotách. Na druhej strane sa prídavok 1,4 vyskytuje pri zvýšených teplotách a je to vtedy, keď v uhlíkoch 1 a 4 existuje rezonancia a výskyt voľných valencií. Príklady jednotlivých prípadov:
* Príklad pridania 1,2 v konjugovaných diénoch:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ─ C ─ CH CH2
│ │
H H
* Príklad pridania 1,4 v konjugovaných diénoch:
H2C CH ─ CH ═ CH2 + H2 → H2C CH ═ CH CH2
│ │
H H
- Hydrogenácia aromatických látok: Väzby pí benzénového kruhu sú prerušené a atómy vodíka sa pridávajú k uhlíkom, ktoré tieto väzby vytvárajú.
Tento typ úplnej hydrogenácie je uvedený nižšie:

Celková hydrogenačná reakcia benzénu
- Cyklická hydrogenácia: Nastáva tvorba alkánu.
Príklad: Hydrogenácia cyklopropánu:
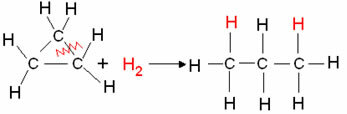
Hydrogenačná reakcia cyklopropánu
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/reacao-organica-hidrogenacao.htm


