Izobarická transformácia nastáva, keď je plyn pri konštantnom tlaku. Napríklad, ak sa uskutoční v otvorenom prostredí, transformácia bude izobarická, pretože tlak bude atmosférický tlak, ktorý sa nezmení.
V takom prípade sa teplota a objem líšia. Dvaja poprední vedci študovali, ako k tejto variácii v izobarických transformáciách dochádza. Prvý, ktorý sa zaoberal objemom a teplotou plynov, bol Jacques Charles (1746-1823) v roku 1787 a potom, v roku 1802, Joseph Gay-Lussac (1778-1850) tento vzťah kvantifikoval.
Tak vznikol zákon, ktorý vysvetľuje izobarické premeny plynov, ktorý sa stal známym ako Charles / Gay-Lussac zákon. Uvádza sa takto:
„V systéme s konštantným tlakom je objem pevnej hmotnosti plynu priamo úmerný teplote.“

To znamená, že ak zdvojnásobíme teplotu, zdvojnásobí sa aj objem obsadený plynom. Na druhej strane, ak znížime teplotu, zníži sa v rovnakom pomere aj objem plynu.
Vidno to na veľmi jednoduchom experimente. Ak umiestnime balónik do hrdla fľaše, zachytí sa fixná masa vzduchu. Ak túto fľašu ponoríme do misky s ľadovou vodou, balón sa nafúkne. Teraz, keď to dáme do misky s horúcou vodou, balón sa naplní.
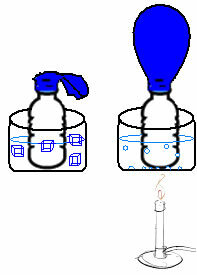
Je to tak preto, lebo pri zvyšovaní teploty sa zvyšuje kinetická energia molekúl plynu a zvyšuje sa aj rýchlosť, akou sa pohybujú. Plyn sa teda rozpína, zvyšuje objem, ktorý zaberá, a balón sa nafúkne. Opak nastane, keď znížime teplotu a vložíme ju do studenej vody.
Tento vzťah medzi teplotou a objemom v izobarických transformáciách je daný nasledujúcim vzťahom:
V. = k
T
„k“ je konštanta, ako je zrejmé z nasledujúceho grafu:
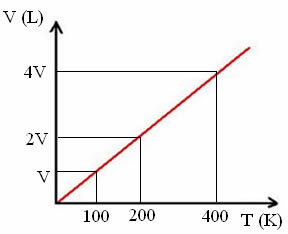
Upozorňujeme, že pomer V / T vždy dáva konštantu:
_V_ =_2V_ = _4V_
100 200 400
Môžeme teda vytvoriť nasledujúci vzťah pre izobarické transformácie:
V.počiatočné = V.Konečné
Tpočiatočné TKonečné
To znamená, že pri akejkoľvek zmene teploty plynu pri konštantnom tlaku môžeme pomocou tohto matematického výrazu zistiť jeho objem. Opak je tiež pravdou, keď poznáme objem plynu, zistíme, pri akej teplote je. Pozri príklad:
„Plynná hmota zaberá objem 800 cm3 pri -23 ° C, pri danom tlaku. Aká je teplota zaznamenaná, keď plynná hmota pri rovnakom tlaku zaberá objem 1,6 l? “
Rozhodnutie:
Údaje:
V.počiatočné = 800 cm3
Tpočiatočné = -23 ° C, pri pripočítaní k 273 máme 250 K (Kelvin)
V.Konečné = 1,6 l
TKonečné = ?
* Najprv musíme nechať hlasitosť na rovnakej jednotke. Je známe, že 1 dm3 sa rovná 1 litru. ako 1 dm3 je rovnaká ako 1 000 cm3, zdá sa, že 1 liter = 1 000 cm3:
1 L 1 000 cm3
x 800 cm3
x = 0,8 l
* Teraz nahradíme hodnoty vzorca a nájdeme konečnú hodnotu teploty:
V.počiatočné = V.Konečné
Tpočiatočné TKonečné
0,8_ = 1,6
250 T.Konečné
0,8 T.Konečné = 250. 1,6
TKonečné = 400
0,8
TKonečné = 500 tis
* Po prechode na stupnicu Celzia máme:
T (K) = T (° C) + 273
500 = T (° C) + 273
T (° C) = 500 - 273
T (° C) = 227 ° C
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm

