Podľa francúzskeho chemika Henryho Louisa Le Chateliera rovnovážny posun je to situácia, v ktorej sa chemická reakcia posúva (dopredu alebo dozadu), keď je vystavená vonkajšiemu rušeniu. Toto tvrdenie navrhnuté chemikom sa stalo známe ako princíp Le Chatelier.
Poznámka: priama reakcia je reakcia, pri ktorej sa reaktanty transformujú na produkty, zatiaľ čo inverzná reakcia je reakcia, pri ktorej sa produkty transformujú na reaktanty.
Reakcia je v rovnováhe, keď je rýchlosť priamej reakcie rovnaká ako rýchlosť reverznej reakcie, to znamená rýchlosti reaktanty sa menia na produkty rovnakou rýchlosťou ako produkty na reaktanty.

Všeobecné znázornenie rovnovážnej chemickej reakcie
Podľa Le Chatelierovho princípu, kedykoľvek sila pôsobí na rovnovážnu reakciu, potom rovnovážny posun dôjde k zrušeniu tohto narušenia a nastoleniu novej rovnovážnej situácie v reakcii.
Poruchy schopné posunúť chemickú rovnováhu oni sú:
→ zmena koncentrácie
keď koncentrácia v množstve hmoty (v mol / L alebo molárnych) účastníka reakcie je zmenený (buď znížený alebo zvýšený),
posun rovnováhy, pokiaľ tento účastník nie je v pevnom stave.Podľa princípu Le Chatelier teda platí, že ak koncentrácia ak dôjde k zvýšeniu účastníka, rovnováha sa posunie opačným smerom k zvýšeniu. Ak však koncentrácia účastník je zmenšený, dôjde k posunu rovnováhy v smere poklesu. Napríklad:

Všeobecné znázornenie rovnovážnej chemickej reakcie
Zvyšovanie koncentrácie A = rovnováha sa posúva doprava
Zníženie koncentrácie B = rovnováha sa posunie doľava
→ Variácia tlak
Variácia tlaku iba podporuje posun v rovnováhe ktoré majú plynné zložky, pretože keď sa zvýši, molekuly zvýšia vzájomné zrážky a keď sa zníži tlak, znížia vzájomné zrážky.
Kolízie medzi molekulami narastajú s pribúdajúcimi tlak, pretože objem (priestor) sa príslušne zníži, zatiaľ čo sa zmenší tlak je sprevádzaný zvyšujúcim sa objemom.
Poznámka: V chemickej rovnováhe analýza účinku úpravy tlaku zohľadňuje molárny objem reaktantov a produktov, ktorý súvisí s reakčnými koeficientmi. V nižšie uvedenej rovnici je objem činidla 4 a produkt 2.
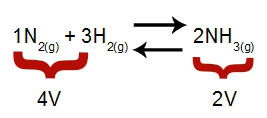
Rovnica, ktorá udáva objemy prítomné pri tvorbe amoniaku
Podľa princípu Le Chatelier, ak sa zvýši tlak v systéme, premiestnenie rovnováha v smere väčšieho objemu, zatiaľ čo pri znížení tlaku dôjde k posunu rovnováha.

Rovnica predstavujúca rovnováhu tvorby amoniaku
Zvyšujúci sa tlak = rovnováha sa posúva doprava (pretože je to strana s menším objemom).
Klesajúci tlak = rovnováha sa posúva doľava (pretože toto je strana s vyšším objemom).
→ Kolísanie teploty
Nárast v teplota rovnovážnej reakcie uprednostňuje molekuly viac sa zrážať, zatiaľ čo pokles o temperaturzmierňuje ich rozrušenie a v dôsledku toho aj šoky. Pretože zvýšenie teploty vždy uprednostňuje reakciu endotermický (taký, ktorý absorbuje energiu).
Analýza vplyvu teploty na rovnováhu zohľadňuje hlavne ΔH reakcie. Ak je ΔH pozitívna, dopredná reakcia bude endotermická, zatiaľ čo opačná bude exotermická. Ak je ΔH záporná, pravá bude exotermická a inverzná endotermická.
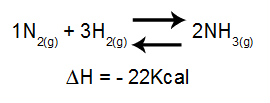
Rovnica obsahujúca zmeny entalpie v tvorbe amoniaku
Zvyšujúca sa teplota = rovnováha sa posúva doľava (pretože toto je smer endotermickej reakcie, pretože ΔH je záporná).
Klesajúca teplota = rovnováha sa posúva doprava (pretože to je smer exotermickej reakcie, pretože ΔH je záporná).
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-deslocamento-equilibrio.htm
