Pri izotermickej transformácii zmena objemu a tlaku určitého plynu, ale konštantná teplota; odtiaľ pochádza pôvod izotermického názvu (z gréčtiny: izo = rovnaké; termo = teplo).
Vedci Boyle a Mariotte izolovane uskutočnili podobné experimenty a výsledkom bolo: s rastúcim tlakom klesá objem plynu.
Pomysli napríklad na piest injekčnej striekačky. Ak na tento piest použijeme externý tlak, to znamená, že ak tlak zvýšime, zníži sa objem vzduchu vo vnútri injekčnej striekačky a naopak.
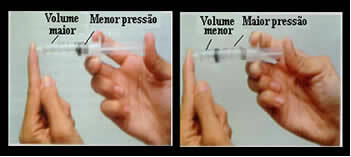
Objem a tlak sú nepriamo úmerné: v ľavom poli je tlak malý a objem zaberaný vzduchom veľký. Vpravo, keď sa na piest injekčnej striekačky použije väčší tlak, objem sa zníži.
Toto nie je ojedinelý prípad, je to niečo, čo sa pri plynoch opakuje s bežnou pravidelnosťou. Preto bola táto skutočnosť uvedená vo forme zákona, ktorý možno charakterizovať nasledovne:
| Boyleov zákon alebo Boyle-Mariottov zákon: Pri konštantnej teplote je objem zaberaný stálou hmotnosťou plynu nepriamo úmerný jeho tlaku. |
To znamená, že ak zdvojnásobíme tlak plynu, jeho objem sa zníži na polovicu a podobne. Keď sú dve také veličiny nepriamo úmerné, ich súčinom je konštanta; teda matematicky možno tento vzťah znázorniť takto:
| P.V = k |
Kde k = konštantná.
Ak teda máme v prvej situácii hodnotu tlaku určitého plynu ako P1 a jeho príslušný objem ako V1, potom musíme:
| P1. V.1 = k |
Ak zvýšime tento tlak na P2, zmení sa aj jeho objem na V2 a opäť budeme musieť:
| P2 . V.2 = k |
Týmto dospejeme k záveru:
| P1. V.1 = P2. V.2 |
Túto konštantu možno vidieť na príklade tlakov a objemov plynu so stálou hmotnosťou, ktorý je uvedený v nasledujúcej tabuľke:
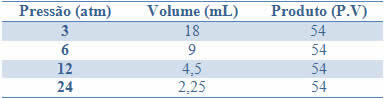
Pomocou grafu týchto hodnôt uvidíme vytvorenie krivky.
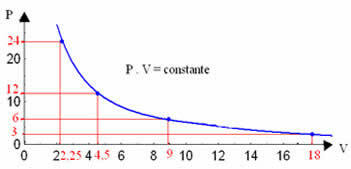
Grafické znázornenie izotermickej transformácie bude vždy hyperbola, bez ohľadu na hodnoty tlaku a objemu a teploty, pri ktorých sa experiment uskutočňoval. Táto hyperbola sa nazýva izoterma; takže ako je zrejmé z nižšie uvedeného grafu, rôzne teploty vedú k vzniku rôznych izoterm.
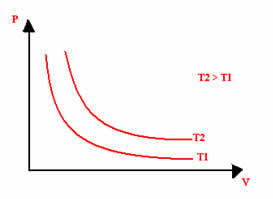
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm