Niektoré zlúčeniny nemusia mať na dosiahnutie stability osem elektrónov vo valenčnej škrupine, preto sa považujú za výnimky z oktetového pravidla. Zistite teraz, prečo niektoré prvky unikajú povinnosti mať v poslednej schránke oktet elektrónov.
Berýlium (Byť)
Je výnimkou z oktetového pravidla, pretože je schopný vytvárať zlúčeniny s dvoma jednoduchými väzbami, takže sa stabilizuje iba so štyrmi elektrónmi vo valenčnom plášti. 
Pretože vodík (H) sa musí vzdať dvoch elektrónov, aby vytvoril väzbu (H - No - H), atóm berýlia (Be) zdieľa svoje elektróny a dosahuje stabilitu.
Hliník (Al)
Je výnimkou z oktetového pravidla, pretože dosahuje stabilitu so šiestimi elektrónmi vo valenčnom plášti. Atóm hliníka má tendenciu darovať svoje elektróny, a tak môže vytvárať tri jednoduché väzby s inými atómami: 
V tomto prípade hliník (Al) vytvoril tri väzby s tromi atómami fluóru (F).
Bór (B)
Tvorí molekulárne látky s tromi jednoduchými väzbami. 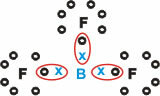
Upozorňujeme, že bór (B) má tendenciu darovať svoje elektróny atómom fluóru (F), ktorý sa riadi oktetovým pravidlom a vyžaduje osem elektrónov vo valenčnej škrupine. Keď sa bór vzdáva svojich elektrónov, fluór sa stabilizuje s vytvoreným oktetom.
Líria Alves
Vyštudoval chémiu
Brazílsky školský tím
Pozrieť viac!
Teória oktetu
Všeobecná chémia - Chémia - Brazílska škola
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm

