dvojitá soľ je názov daný jednej z klasifikácií, ktoré anorganické soli môže prijímať. Ostatné klasifikácie sú: jednoduché, kamenec, hydroxylované, hydrogenovaný a hydratované. Aby mohla byť anorganická soľ charakterizovaná ako dvojitá soľ, musí mať jednu z nižšie opísaných kombinácií:
Katión (Y) a akékoľvek dva anióny (X a W) a predstavuje nasledujúci vzorec:
YXW
Anión (X) a akékoľvek dva katióny (Y a Z) a predstavuje nasledujúci vzorec:
YZX
Poznámka: Tieto soli vznikajú, keď a neutralizačná reakcia sa vykonáva medzi dvoma základne iný a jeden kyselinaalebo medzi dvoma rôznymi kyselinami a zásadou.
Pravidlo pomenovania pre dvojnásobnú soľ
Aby sme menovali a dvojitá soľ, je potrebné najskôr poznať jej zloženie, pretože pre každý druh podvojnej soli existuje osobitné pravidlo pomenovania, ktoré je zrejmé nižšie:
a) Pravidlo nomenklatúry pre dvojitú soľ s dvoma katiónmi
Keď jeden dvojitá soľ má dva katióny, musíme použiť nasledujúce pravidlo:

Pravidlo nomenklatúry používané pre dvojité soli s dvoma katiónmi
Nasledujú dva príklady použitia tohto pravidla pomenovania:
1. príklad: Riadok4s
Táto soľ sa skladá z:
Anión: sulfid (S-2);
Elektropozitívnejší katión: lítium (Li+1);
Menej elektropozitívny katión: amónny (NH4+1).
Preto sa volá lithium (double) amonium sulfid.
2. príklad: RbCaBO3
Táto soľ sa skladá z:
Anión: boritan (BO3-3);
Elektropozitívnejší katión: rubídium (Rb+1);
Menej elektropozitívny katión: vápnik (Ca+2).
Jeho názov je teda boritan (dvojitý) rubídia a vápnika.
b) Pravidlo nomenklatúry pre dvojitú soľ s dvoma aniónmi
Keď jeden dvojitá soľ má dva anióny, musíme použiť nasledujúce pravidlo:
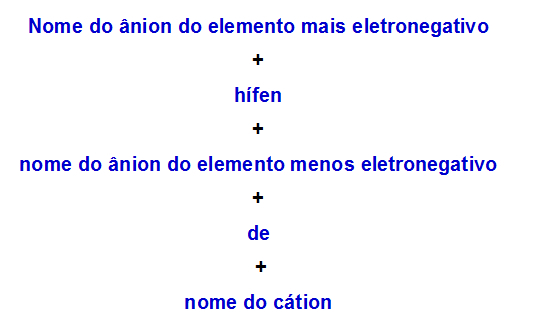
Pravidlo nomenklatúry používané pre dvojité soli s dvoma aniónmi
Tu sú dva príklady uplatnenia tohto pravidla:
1. príklad: MgFI
Táto soľ sa skladá z:
Katión: horčík (Mg+2);
Najelektronegatívnejší anión: fluorid (F-1);
Menej elektronegatívny anión: jodid (I-1).
Preto sa volá fluorid jodid horečnatý.
2. príklad: ZnNO2br
Táto soľ sa skladá z:
Katión: zinok (Zn+2);
Elektronegatívnejší anión: dusitany (NO2-1);
Menej elektronegatívny anión: bromid (br-1).
Preto sa volá nitrit-bromid zinočnatý.
Zloženie n-podvojnej soli z jej nomenklatúry
a) Na dvojitú soľ s dvoma katiónmi
Konštrukcia vzorca a dvojitá soľ záleží to od znalosti jeho názvu, ktorý je štandardizovaný ako v prípade všetkých solí, to znamená najskôr katiónu a potom aniónu. Pretože podvojná soľ môže mať dva katióny, ich poradie a umiestnenie vo vzorci sa riadi krstným menom.
1. príklad: pyrofosforečnan bárnatý nikel II
Táto soľ obsahuje fosfát (P2O7), bárium (Ba+2) a nikel II (Ni+2), katióny napísané v tomto poradí. Takže jeho vzorec je BaNiP2O7.
2. príklad: fosforečnan meďnatý II a zlato I
Táto soľ obsahuje fosfát (PO4-3), meď II (Cu+2) a zlato I (Au+1), katióny napísané v tomto poradí. Preto je jeho vzorec CuAuPO4.
b) Pre dvojnásobnú soľ s dvoma aniónmi
V prípade dvojitá soľ s dvoma aniónmi sa tiež riadime pri umiestňovaní aniónov do vzorca poradie, v akom sa vyskytujú v danom mene.
1. príklad: síran jodičitý nikelnatý III
Táto soľ má síranové anióny (SO4-2) a jodid (I-1), napísaný v tomto poradí, a katión niklu III (Ni+3). Takže jeho vzorec je NiSO4I.
2. príklad: kyanid fosforečnan olovnatý IV
Táto soľ má fosfátové anióny (PO4-3) a kyanidom (KN-1), napísaný v tomto poradí, a katión olova IV (Pb+4). Takže jeho vzorec je PbPO4KN.
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm

