Jeden Tlmivého roztoku je zmes používaná na zabránenie zmeny pH alebo pOH média po pridaní silných kyselín alebo silných zásad.
Existujú dva typy tlmivého roztoku:
1. Zmes slabej kyseliny s jej konjugovanou bázou;
2. Zmes slabej zásady s jej konjugovanou kyselinou.
Pozrime sa na príklady každého z nich a na to, ako fungujú, keď sa do média pridá malé množstvo silnej kyseliny alebo zásady:
1. Zmes slabej kyseliny s jej konjugovanou bázou:
Na vytvorenie takého roztoku sa slabá kyselina zmieša so soľou rovnakého aniónu ako kyselina.
Zvážte napríklad tlmivý roztok pozostávajúci z kyseliny octovej (H3CCOOH(tu)) a octan sodný (H3CCOONas). Vidieť, že oba majú acetátový anión: (H3CCOO-(tu)). Koncentrácia týchto iónov je prakticky spôsobená disociáciou soli, ktorá je veľká. Kyselinová ionizácia je malá.

Teraz si všimnite, čo sa stane v nasledujúcich možnostiach pridania:
- Pridanie malého množstva silnej kyseliny:
Prídavok silnej kyseliny zvyšuje koncentráciu hydróniového iónu H3O+1, a pretože kyselina octová je slabá kyselina, má acetátový anión vysokú afinitu k protónu (H
+) hydrónium. Týmto spôsobom reagujú a vzniká viac kyseliny octovej:
Vďaka tomu sa pH média prakticky nemení. Ak sa však pridá viac a viac silnej kyseliny, príde čas, keď sa spotrebuje všetok octanový anión a tlmivý účinok sa zastaví.
- Pridanie malého množstva silnej bázy:
Pridanie silnej bázy zvyšuje koncentráciu iónov OH-. Ale tieto ióny sú neutralizované H iónmi3O+1 uvoľňovaný pri ionizácii kyseliny octovej:

S touto reakciou, koncentrácia H iónov3O+1(tu) sa zníži a dôjde k posunu v rovnováhe smerom k zvýšeniu kyslej ionizácie, a preto bude kolísanie pH roztoku veľmi malé. Koncentrácia iónov H3O+1(tu) bude to prakticky stále.
V tomto prípade existuje aj limitná kapacita medzipamäte. Ak teda pridáme viac a viac bázy, rovnováha kyslej ionizácie sa bude posúvať čoraz viac smerom k jej ionizácii, až kým sa nespotrebuje všetka kyselina.
2. Zmes slabej zásady s jej konjugovanou kyselinou:
Tento typ tlmivého roztoku je tvorený slabou zásadou a soľným roztokom, ktoré obsahujú rovnaký katión ako zásada.
Zvážte napríklad tlmivý roztok tvorený hydroxidom horečnatým, MgOH2 (aq) (slabá báza) a chlorid horečnatý, MgCl2 (s) (soľ). Oba obsahujú katión horčík (Mg2+(tu)). Ióny horčíka prítomné v médiu sú prakticky všetky odvodené z disociácie soli, pretože disociácia bázy je slabá:
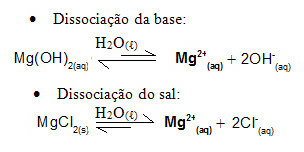
- Pridanie malého množstva silnej kyseliny:
V tomto prípade sú to ióny H.3O+1 pochádzajúce z pridania silnej kyseliny budú neutralizované iónmi OH-, pochádzajúce zo slabej disociácie bázy. Tým sa posunie základná disociačná rovnováha doprava.
Takže zmena pH (ak existuje) bude veľmi malá, pretože koncentrácia iónov OH je- zostáva konštantná. Pufrovací efekt prestane, keď sa disociuje celá báza.
- Pridanie malého množstva silnej bázy:
Pridaná silná báza podlieha disociácii a uvoľňuje OH ióny-. Pretože hydroxid horečnatý je slabá báza, bude mať horčík uvoľnený pri disociácii zo soli väčšiu tendenciu reagovať s OH-:

Preto je nárast iónov OH- je kompenzované proporcionálnym zvýšením Mg (OH)2 (aq). Vďaka tomu pH neprechádza zásadnými zmenami.
Tento efekt končí, keď sa spotrebuje všetok horčíkový katión.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm