THE chróm, atómové číslo 24, je prechodný kov nachádzajúci sa v skupine 6 periodickej tabuľky. Jeho farba je sivastá, ale je to aj veľmi lesklý kov. Existuje hlavne v oxidačnom stupni +2, +3 a +6 a má tú vlastnosť, že všetky jeho zlúčeniny sú farebné. Niet divu, že jeho názov pochádza z gréčtiny chroma, čo znamená farba.
Tento prvok sa získava prostredníctvom chromitu a je široko používaný v metalurgickom priemysle, pri výrobe nehrdzavejúcej ocele a iných špeciálnych zliatin. Chróm je možné galvanicky pokovovať aj na predmetoch, v efekte známom ako chrómovanie, ktorý zaručuje okrem krásy aj veľkú chemickú odolnosť. Zlúčeniny chrómu sa okrem žiaruvzdorných materiálov používajú aj v pigmentoch a farbách.
Prečítajte si tiež: Hafnium — prechodný kov, ktorý má vlastnosti podobné zirkónu
zhrnutie chrómu
Chróm je sivastý, lesklý kov, ktorý otvára skupinu 6 Periodická tabuľka.
Je veľmi odolný voči korózii a chemickému napadnutiu pri izbovej teplote.
Predstavuje najmä oxidačné stavy +2, +3 a +6.
Všetky jeho zlúčeniny majú farbu.
Dá sa získať z chromitu, FeCr2THE4.
Využíva ho najmä hutnícky priemysel, ktorý ho využíva pri výrobe nehrdzavejúca oceľ.
Objavil ho v roku 1797 Francúz Louis Nicolas Vauquelin.
[pullicity_omnia]
vlastnosti chrómu
Symbol: Cr.
Atómové číslo: 24.
Atómová hmotnosť: 51,9961 c.u.s.
Elektronegativita: 1,66.
Fúzny bod: 1907 °C.
Bod varu: 2671 °C.
Hustota: 7,15 g.cm-3 (pri 20 °C).
Elektronická konfigurácia: [vzduch] 4 s1 3d5.
Chemická séria: skupina 6, metais prechod.
vlastnosti chrómu
Chróm, atómové číslo 24, je a kov sivej farby, tvrdé a lesklé. Pri izbovej teplote dobre odoláva chemickým útokom, ako sú kyslé alebo zásadité roztoky, s výnimkou HCl a H2IBA4 zriedený. Pri vyšších teplotách sa však chróm stáva oveľa reaktívnejším a ľahko sa oxiduje O2a kombinuje sa s halogénmi a väčšinou nekovov.
V roztoku majú zlúčeniny chrómu oxidačné čísla +6, +3 a +2. V skutočnosti je to zaujímavá funkcia všetky zlúčeniny chrómu sú farebné, ako je dvojchróman z draslík, K2Cr2THE7, ktorý je oranžový, a chróman draselný, K2CrO4, ktorá je žltá.
Zaujímavým faktom o chróme je to jeho elektrónová konfigurácia nezodpovedá očakávanému vzoru. vytváranie vašich elektronická distribúcia, očakáva sa, že to bude [Ar] 4s2 3d4avšak výpočty energie a stability ukazujú, že konfigurácia [Ar] 4s1 3d5 je stabilnejší. To možno vysvetliť tým Hundovo pravidlo.
Podľa tohto pravidla, čím väčší počet elektróny s rovnakými (alebo paralelnými) rotáciami v neúplnom orbitále, tým nižšia je energia atóm, teda čím väčšia stabilita. Pozrite sa na obrázok nižšie:
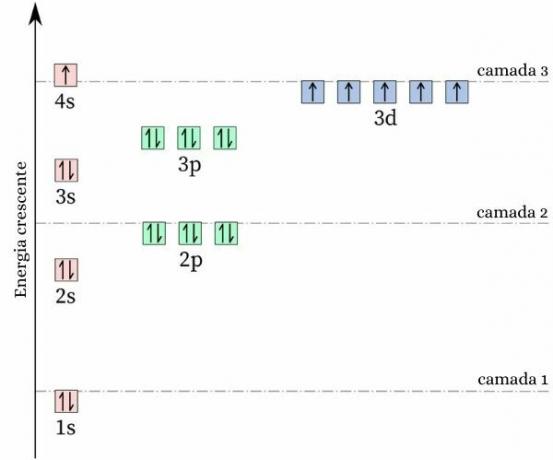
Ak chróm prijal konfiguráciu 4s2 3d4, orbitál 4s by predstavoval elektróny s opačným spinom (↑↓), čo by zvýšilo odpudivosť, napokon by existovali dva náboje rovnakého znamienka zdieľajúce jeden orbitál.
Prijatím konfigurácie 4s1 3d5, chróm má väčší počet elektrónov s rovnakým spinom, bez prítomnosti elektrónov zdieľajúcich rovnaký orbitál (ako je znázornené na predchádzajúcom obrázku), čo znižuje jeho energiu a zaručuje väčšiu stabilitu.
Pozri tiež: Vanád — chemický prvok, ktorého roztoky majú tiež rôzne farby
Kde sa dá nájsť chróm?
chróm je desiaty najrozšírenejší prvok na Zemi. Hoci existuje niekoľko minerálov, ktoré majú vo svojom zložení chróm, chromit, FeCr2THE4, je najdôležitejším minerálom chrómu, ktorý je komerčne najviac využívaný.

Je dôležité zdôrazniť, že krajiny s najvyššími zásobami chrómu sú:
južná Afrika;
Kazachstan;
India;
Turecko.
THE Brazília je jediným výrobcom chrómu na celom americkom kontinente, ale drží len 0,11 % svetových zásob. Zásoby sú distribuované najmä v týchto štátoch:
Bahia;
amapá;
Minas Gerais.
Získanie chrómu

THE vyrába sa kovový chróm cez z chromitu. V tomto prípade sa minerál taví s uhličitan sodný, O2CO3za prítomnosti vzduchu, pričom vzniká chróman sodný a oxid železitý:
4 FeCr2THE4 + 8 palcov2CO3 + 7 O2 → 8 palcov2CrO4 + 2 Fe2THE3 + 8 CO2
Odtiaľ sa vykonáva extrakcia s Voda, keďže Na2CrO4 je rozpustný vo vode, zatiaľ čo Fe2THE3 nie. Potom sa médium okyslí H2IBA4, ktorý umožňuje kryštalizáciu chrómanu z sodík. potom2CrO4 sa redukuje na oxid chrómu III s použitím uhlíka pri vysokej teplote:
o2CrO4 + 2 C → Cr2THE3 + zapnuté2CO3 + CO
Kovový chróm sa potom získa, keď sa hliník použije ako redukčné činidlo, tiež pri vysokej teplote:
Cr2THE3 + 2 Al → Al2THE3 + 2 kr
chrómové aplikácie
THE priemyslu hutnícky je hlavným spotrebiteľom chrómu s približne 80 % všetkého vyrobeného chrómu, buď vo forme chromitu alebo koncentrátu Cr.2THE3. Je to preto, že chróm je schopný vytvárať zliatinu ferochrómu, ktorá je základným zdrojom jej získavania nehrdzavejúca oceľ a iné špeciálne zliatiny.
Chróm, ktorý zvyčajne tvorí 18 % nehrdzavejúcej ocele, výrazne zvyšuje odolnosť ocele voči oxidácii (korózii) a iným chemickým vplyvom. V iných špeciálnych zliatinách hrá chróm tiež úlohu pri zvyšovaní kaliteľnosti, tvrdosti a húževnatosti materiálov.

THE žiaruvzdorný priemysel Je tiež dobrým spotrebiteľom chrómu, keďže chromit je známy žiaruvzdorný materiál, teda materiál schopný odolávať tepelným, chemickým a fyzikálnym vplyvom, ktoré sa vyskytujú v priemysle. Chromit, používaný na výrobu žiaruvzdorných tehál, je veľmi odolný voči degradácii pri vystavení zahrievaniu.
už ten chemický priemysel sa snaží používať chróm niekoľkými spôsobmi:
ako katalyzátor;
ako inhibítor korózie;
v pochrómovaní;
v pigmentoch;
vo farbiacich zmesiach.
Je dobre známe chrómovanie, ktoré pozostáva z vytvorenia ochrannej vrstvy chrómu na predmete, ktorý ho chráni pred koróziou. V tomto procese sa chróm nanáša na predmet, ktorý sa má chrómovať elektrolýza síran chrómový, Cr2(LEN4)3, vyrobený rozpustením Cr2THE3 v H2IBA4.
Chrómové pigmenty sú veľmi bežné, najmä s rôznymi farbami, ktoré možno získať ich zlúčeninami. Pri rozpúšťaní hexahydrátu chloridu chromitého, CrCl3·6 hodín ráno2O, získa sa fialový roztok. Na druhej strane, pri rozpúšťaní síranu chromitého, Cr2(LEN4)3získa sa zelená farba.
Roztok chloridu chromitého, CrCl2, je modrý, zatiaľ čo octan chrómu II, Cr2(prevádzkový riaditeľ)4, je červená pevná látka. Oxid chrómu II, CrO2, je to čierne; chróman draselný, K2CrO4a žltá; dvojchróman draselný, K2Cr2THE7a oranžová; trichróman draselný, K2Cr3THE10, je to červené; a oxid chrómový, CrO3, je tiež červená.
zaujímavé:Rubíny sú vlastne drahokamy so vzorcom Al2THE3, ktoré majú vo svojom zložení stopy chrómu. To je aj prípad smaragdu, formy berylu, ktorého zelená farba je výsledkom malého množstva chrómu.
Tiež vedieť:Tungsten — sivastý kov, ktorého farba pripomína oceľ
Vzťah Chromium k zdraviu
Biologickú úlohu majú dva oxidačné stavy chrómu. Pozrime sa ďalej.
→ Šesťmocný chróm (Cr6+)
S ohľadom na Cr6+, je známe, že môže byť považovaný za karcinogénnynajmä pri vdýchnutí alebo požití veľkého množstva.
→ Trojmocný chróm (Cr3+)
Trojmocný chróm bol vždy zvážiť podstatný prvok. Výživový doplnok chrómu v tejto forme sa stal populárnym na podporu základných stopových prvkov a ako prostriedok na chudnutie. Diskutuje sa aj o tom, že pri liečbe by bolo zaujímavé podávanie trojmocného chrómu diabetes 2. typu, ako aj na tehotenskú cukrovku.
Hoci, niektorí autori uviedli táto zásada, o ktorej sa diskutuje. Myšlienka je taká, že chróm, či už suplementovaný alebo nie, nemá vplyv na zloženie tela, metabolizmus dáva glukózy alebo citlivosť na inzulín. Predpokladá sa, že v skutočnosti má najvyššia dávka chrómu farmakologické a nevýživové účinky, čo naznačuje, že ide o základný prvok.
históriu chrómu
Názov chróm pochádza z gréčtiny chroma, čo znamená farba. Po tom, čo sme tomuto prvku dali aj názov, došlo k jeho objaveniuFrancúzsky lekárnik a chemik Louis Nicolas Vauquelinv roku 1797, keď si všimol chróm pri štúdiu krokoitovej rudy, PbCrO4. Spočiatku však tento kov nemal veľký komerčný úspech.
Napríklad pätnásť rokov po jeho objave Sir Humphry Davy o chróme a jeho zlúčeninách veľa nevedel, keď napísal svoju slávnu knihu Prvky chemickej filozofie, čo naznačuje len to, že kyselina chrómová mala kyslú chuť.
V tom istom roku Jöns Jacob Berzelius napísal, že pachuť jedovatej kyseliny chrómovej bola nepríjemná a kovová. Berzelius si uvedomil, že kov, hoci je krehký, je celkom odolný voči pôsobeniu kyseliny a atmosférický vzduch.
Hoci spočiatku nešlo o veľký komerčný úspech, koncom 19. storočia a začiatkom 20. storočia, prvok sa začali komerčne využívať, keďže sa začala vo veľkej miere používať nehrdzavejúca oceľ, ako aj chrómovanie dielov v automobilovom priemysle, čím sa chróm stal veľmi žiadaným kovom.
Chromium vyriešené cvičenia
Otázka 1
(UEFS/BA)Atóm chrómu má v druhu oxidačné číslo +3
A) Kr2THE3
B) CrO
C) Cr
D) CrO42-
E) Cr2THE72-
Rozhodnutie:
Alternatíva A
V písmene C sa chróm objavuje ako jednoduchá látka, teda v tomto prípade NOx sa rovná nule.
THE kyslík v ostatných zlúčeninách sa vyskytuje s NOx rovným -2. Môžeme teda vypočítať NOx chrómu vo všetkých druhoch, čím sa stáva neznámym (x):
Cr2THE3 → 2x + 3(-2) = 0 ⸫ x = +3
CrO → x + (-2) = 0 ⸫ x = +2
CrO42- → x + 4(-2) = -2 ⸫ x = +6
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
otázka 2
(UPE 2013) Medzinárodná skupina vedcov objavila komplexnú chemickú reakciu zodpovednú za zhoršenie niektorých z nich veľké umelecké diela v histórii, ktoré vytvoril Vincent van Gogh (1853–1890) a ďalší slávni maliari 20. XIX. Vo svojich výskumoch títo výskumníci umelo starli pigmenty a zistili, že stmavnutie vrchnej vrstvy súviselo so zmenou chrómu prítomného v nátere z Cr(VI) na Cr(III).
Dostupné v: http://agencia.fapesp.br/13455 (prispôsobené)
údaje:Cr (Z = 24), elektronická konfigurácia: [Ar] 4s1 3d5
Vzhľadom na vyššie opísanú situáciu je SPRÁVNEtvrdiť, že (ten)
A) oxidácia Cr(VI) na Cr(III) znehodnotila veľké umelecké diela v histórii.
B) starnutie rámov súvisí s elektronickým budením CuThe pre Cr3+.
C) Proces redukcie Cr6+ pre Cr3+ zakryl slávne diela 19. storočia.
D) transformácia, ktorá prebehla, zoxidovala CuThe, zodpovedný za lesk pôvodnej maľby.
E) zmena z Cr(VI) na Cr(III) je chemická reakcia, ku ktorej dochádza až po mnohých rokoch.
Rozhodnutie:
Alternatíva C
Prechod z Cr(VI) na Cr(III) je proces zníženie (pokles NOx), ktorý bol zodpovedný za stmavnutie obrazoviek.
Autor: Stefano Araújo Novais
Učiteľ chémie

