Kapacita, ktorú musia spojenia priťahovať elektrické náboje, je definovaná ako polarita, ktorá nadobúda odlišný charakter v závislosti na pripojení, kde je prítomné.
Najčastejšie väzby organických zlúčenín sa vyskytujú medzi atómami uhlíka alebo medzi atómami uhlíka a vodíka: C ─ C a C ─ H (uhľovodíky). Tento typ väzby klasifikujeme ako kovalentný, je prítomný vo všetkých väzbách organických zlúčenín tvorených iba uhlíkom a vodíkom.
Keď sa v molekule organickej zlúčeniny nachádza okrem uhlíka a vodíka aj iný chemický prvok, jeho molekuly budú mať určitú polaritu. Tento prvok nazývame heteroatóm a môže to byť okrem iného dusík (N), kyslík (O).
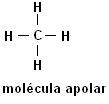
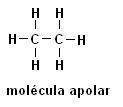
Metán (CH4) Etán (C.2H6)
Upozorňujeme, že v obidvoch štruktúrach nie sú prítomné heteroatómy, v tomto prípade sú molekuly klasifikované ako nepolárne.


Prítomnosť kyslíka ako heteroatómu spôsobuje, že molekuly vykazujú polaritu. Prvou molekulou je zlúčenina etanol (CH3CH2oh), prítomnosť hydroxylu - OH dáva tejto zlúčenine polárny charakter, aj keď vo svojej štruktúre obsahuje nepolárnu časť.
Líria Alves
Vyštudoval chémiu
Brazílsky školský tím
Pozrieť viac! plochý izomér
Organická chémia - Chémia - Brazílska škola
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm
