S touto triedou bude študent môcť
1. Vysledovať chronologickú líniu historicko-vedeckého vývoja skúmania zloženia hmoty, od konceptu atómu vytvoreného gréckymi filozofmi až po súčasný model atómu.
2. Diferencujte vyvinuté atómové modely, súvisiace teórie a vývoj reprezentácie štruktúry atómu.
3. Vedieť identifikovať a rozlíšiť častice, ktoré tvoria atóm.
1. Diskusia o zložení veci
Prezentovanie rôznych materiálov študentom a podnecovanie diskusie o tom, z čoho sú vyrobené, ponorením sa do charakteristík, až kým sa nedosiahne spoločná zložka všetkých z nich: atóm.
2. Teoretická prezentácia témy
Prezentovať vývoj teórií o zložení materiálov, koncepciu atómu a prínos vedcov k vytvoreniu modelov reprezentujúcich atómy.
Zdôraznite rozdiely medzi modelmi atómov a zdôraznite, že informácie o atóme boli objavené a viedli k vytvoreniu nových modelov.
3. Hodnotenie
Umožnite študentovi uviesť do praxe to, čo sa naučil, pomocou zoznamu cvičení.
1. Vývoj klasifikácie chemických prvkov
Predstavte modely používané na klasifikáciu chemických prvkov, kto boli ich tvorcami, aké prvky boli dovtedy známe a aké informácie používali pred dosiahnutím štandardu prúd.
2. Prezentácia chemických prvkov
Ukážte žiakom chemické prvky, ako sú zastúpené v tabuľke a kde ich možno nájsť v bežnom živote. Zdôraznite objav niektorých prvkov, ako je fosfor, prvý objavený prvok, vodík, najrozšírenejším prvkom vo vesmíre a ortuť, jediný kov v tekutom stave pri izbovej teplote.
3. Atómové číslo a štruktúra atómu
Skontrolujte štruktúru atómu a zistite, kde sa nachádzajú protóny. Vysvetlite, prečo je periodická tabuľka usporiadaná podľa rastúceho atómového čísla, teda počtu protónov.
4. Prezentácia periodickej tabuľky
Zdôraznite, že 118 známych chemických prvkov je rozdelených do 18 skupín a 7 období periodickej tabuľky a dôležitosť tohto nástroja. Definujte, aké sú skupiny a obdobia, predstavte hlavné charakteristiky.
S touto triedou bude študent môcť
1. Identifikujte pojem chemických väzieb a hlavné typy (iónové, kovalentné a kovové).
2. Vysvetlite, prečo sa atómy spájajú a ako vznikajú chemické látky.
3. Definujte oktetové pravidlo, vysvetlite, čo je mocnosť atómov a jej význam pre štúdium chemických väzieb.
4. Poznať, opísať a charakterizovať modely chemických väzieb, ako vznikajú a aké typy zlúčenín tvoria.
1. Ako vznikajú chemikálie?
Použite praktické príklady z každodenného života na stimuláciu rozvoja myšlienok v triede o zložení materiálov. Ako príklad môžete použiť kuchynskú soľ a cukor, aby ste ukázali rozdiely medzi vlastnosti a štruktúry zlúčenín, aby sa študenti zamysleli, kým nedospejú ku konceptu väzby chémia.
2. oktetová teória
Oboznámiť študentov s Lewisovou štruktúrou a distribúciou elektroniky na reprezentáciu atómov a uľahčiť vizualizáciu valenčného obalu a valenčných elektrónov. Predstavte koncept oktetovej teórie a použite skupinu vzácnych plynov ako príklad na porovnanie jeho stabilita a charakteristiky s prvkami z iných skupín, ako sú alkalické kovy a halogény.
3. Typy chemických väzieb
Definujte každý typ chemickej väzby a zdôraznite, ako sa vyskytujú, na čo slúžia a typy chemických väzieb. Pokračujte v používaní praktických príkladov, aby študenti dokázali prepojiť naučené pojmy s každodennými problémami.
Účelom hodiny je prezentovať prehľad chemických väzieb. Následne by sa mali vyučovať špecifické triedy pre každý typ, aby ste sa hlbšie ponorili do témy.
4. Periodická tabuľka a štúdium chemických väzieb
Predstavte periodické vlastnosti elektronegativita a elektropozitivita a ako sú dôležité pre vytváranie chemických väzieb. Ukážte v periodickej tabuľke, kde sú prvky s najväčšou tendenciou darovať a prijímať elektróny.
1. Čo je chemická reakcia?
Učiteľ môže použiť každodenný chemický jav na znázornenie chemickej reakcie, ako je hrdzavenie klinca, horenie dreva alebo šumenie pilulky a stimulácia účasť študenta na výpočte účinkov, ktoré viditeľne naznačujú výskyt reakcie, ako je zmena farby, zmena teploty, tvorba pevných látok a uvoľňovanie plynov. Potom zhromaždite informácie a spoločne dospejte k definícii chemickej transformácie.
2. Rozdiel medzi chemickou transformáciou a fyzikálnou transformáciou
Predstavte rôzne javy a požiadajte žiakov, aby ich klasifikovali ako fyzikálne a chemické zmeny. Zamerajte sa na sledovanie zloženia materiálov pred a po transformácii a zdôraznite typ zmeny pozorované v štruktúre, aby sa rozlíšili fyzikálne a chemické javy týkajúce sa vzniku alebo netvorenia nového látok.
3. Znázornenie chemických reakcií
Použite periodickú tabuľku ako návod, ako opísať chemické zlúčeniny a následne aj chemické prvky zapojené do reakcie.
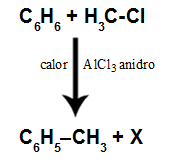
Začnite vytvorením všeobecných reprezentácií na opravu definície a prezentáciu členov chemickej rovnice. Napríklad pre adičnú reakciu sú A a B reaktanty a AB je produkt:
A + B → AB
Potom zaveďte chemické reakcie, ktoré skutočne prebiehajú. Pre tento typ reakcie máme tvorbu sulfidu železa II.
Fe + S → FeS
Malo by sa tiež zdôrazniť dôležitosť vyrovnávania chemických rovníc a to, že počet atómov prítomných v reaktantoch sa musí rovnať počtu atómov v produkte. Popíšte aj fyzikálny stav zložiek: tuhá látka (s), kvapalina (l) a plyn (g).
4. Zákony chemických reakcií
Ponderálne zákony sú zákony, ktoré riadia chemické reakcie a poskytujú návod na kvantitatívne aspekty transformácií. Žiak si preto musí vedieť zafixovať výroky týchto zákonov a aplikovať ich pri písaní chemických reakcií.
5. Druhy chemických reakcií
Prezentujte rôzne typy chemických reakcií prostredníctvom videí, napríklad s premenami v každodennom živote, aby ste uľahčili vnímanie štruktúry chemických zlúčenín.
Uveďte tiež podmienky, za ktorých môžu reakcie prebiehať a kde ich znázorniť v chemickej rovnici, ako je svetlo, teplo, katalyzátor atď.
1. Uveďte rôzne látky a chemický vzorec, ktorý predstavuje zloženie každej z nich. Ukážte prostredníctvom znázornenia atómov chemických prvkov, akými látkami môžu byť tvorené jedným typom prvku (jednoduché látky) alebo viacerými chemickými prvkami (látky kompozity).
2. Pripomeňte si pojmy chemických väzieb a vysvetlite, ako sa atómy spájajú a vytvárajú iónové zlúčeniny (iónová väzba) a molekuly (kovalentné väzby).
3. Pamätajte, že okrem čistých látok môžu byť tvorené aj materiály, ktoré poznáme zmesi (homogénne alebo heterogénne) a prezentovať príklady tak, aby ich študenti boli schopní odlíšiť.