Čím vyššia je teplota, tým vyššia je rýchlosť reakcie.
To je ľahko viditeľné v mnohých situáciách nášho každodenného života, ako sú nasledujúce príklady:
- Ak chceme spomaliť rozkladnú reakciu potraviny, znížime teplotu a umiestnime ju do chladničky;

- Ak chceme urýchliť reakciu jedla na varenie, stačí ju vložiť do hrnca na varenie. tlak, ktorý so zvyšujúcim sa tlakom zvyšuje aj teplotu varu kvapalnej vody, v ktorej jedlo je;

- Požiare sú vo všeobecnosti zvyčajne zničujúce, pretože sa zvyšuje teplota prostredia, čo spôsobuje zvýšenie rýchlosti spaľovacej reakcie;
- Na spomalenie metabolických chemických procesov, zníženie šance na poškodenie mozgu v dôsledku nedostatok kyslíka, niektoré chirurgické zákroky sa vykonávajú znížením telesnej teploty pacienta, pričom zostáva okolo 15 ° C;
- Ak dáme šumivú tabletu do pohára horúcej vody a ďalšiu do pohára studenej vody, prvá sa rozpustí oveľa rýchlejšie.
Čo však vysvetľuje priamy proporcionálny vplyv teploty na reakčnú rýchlosť?
Je to preto, lebo ako je vysvetlené v texte „
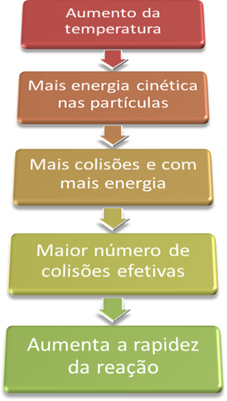
Podmienky pre výskyt chemických reakcií”, Aby reakcia mohla pokračovať, je potrebné splniť určité podmienky, napríklad to, že častice musia sa zrážať efektívne a s minimálnou potrebnou energiou, ktorá sa nazýva aktivačná energia.Keď teda zvýšime teplotu systému, zvýšime aj miešanie reagujúcich častíc a poskytneme im viac kinetickej energie. S týmto dôjde k ďalším kolíziám a k väčšej energii, čo zvýši množstvo častíc, ktoré budú reagovať, a následne zvýši rýchlosť reakcie.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm