Kyslý dážď je jav spôsobený znečistením ovzdušia. Najmä spaľovaním fosílnych palív v priemysle a v automobiloch ľudia uvoľňujú veľké množstvo znečisťujúcich plynov, ako sú niektoré oxidy.
Oxidy sú binárne anorganické zlúčeniny, ktoré majú kyslík ako najviac elektronegatívny prvok. Medzi nimi máme triedu kyslých oxidov, ktoré sa tak nazývajú, pretože reagujú s vodou, pričom vytvárajú kyseliny, a tiež reagujú so zásadami, pričom tvoria vodu a soľ.
Hlavnými kyslými oxidmi, ktoré sa uvoľňujú do atmosféry a ktoré reagujú s dažďovou vodou za vzniku kyslých dažďov, sú oxidy síry (SO2 a tak3) a dusík (N2O, NIE a NIE2).
Myšlienková mapa: Kyslý dážď

*Ak si chcete stiahnuť myšlienkovú mapu vo formáte PDF, Kliknite tu!
Najväčšími darebákmi sú oxidy síry, pretože, ako ukazujú chemické rovnice nižšie, reagujú s vodou a tvorí kyselinu sírovú, rovnakú kyselinu používanú v autobatériách, ktorá je veľmi kyslá. silný:
s(s) + O2(g) → OS2(g)
IBA2(g) + H2O(1)→ HSO3 (vod.) (kyselina sírová)
IBA2(g)+ ½2(g) → OS3(g)
IBA3(g) + H2O(1)→ H2IBA4 (aq)(Kyselina sírová)
Oxidy dusíka reagujú s dažďovou vodou za vzniku kyseliny dusičnej (HNO3) a kyselina dusitá (HNO2), čo môže časom spôsobiť určitý vplyv na životné prostredie.
N2(g) + 202(g) → 2 NIE2(g)
NA2(g) + H2O(1)→ HNO2 (aq) + HNO3 (vod.)
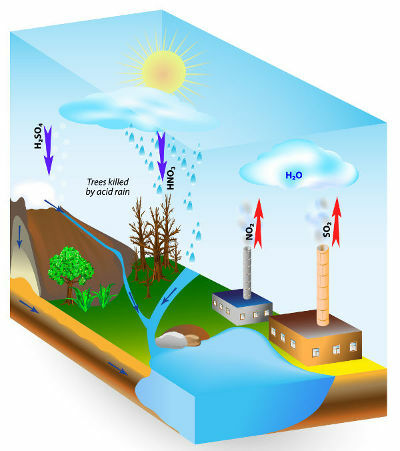
Schéma príčin kyslých dažďov
Tento výraz „kyslý dážď“ prvýkrát použil anglický chemik a klimatológ Robert Angus Smith pri opise kyslých zrážok, ku ktorým došlo nad Manchestrom na začiatku priemyselnej revolúcie.
V skutočnosti je každý dážď kyslý, pretože pH jeho vody je prirodzene nižšie ako 7, najmä okolo 5,6, vzhľadom na normálnu prítomnosť oxidu uhličitého (CO2) v atmosfére, ktorá reaguje s vodou a vytvára kyselinu uhličitú (H2CO3), slabá kyselina.
Avšak, odborne sa to nazýva „kyslý dážď“ každý dážď, ktorý získa pH nižšie ako 4,5.
Obavy súvisiace s výskytom kyslých dažďov nastávajú, pretože spôsobujú viaceré environmentálne škody, ktoré prinášajú problémy pre rastliny, ničenie listov a konárov stromov, pre pôdu, spôsobujúce jej chemickú premenu, pre vody riek a jazier, čo vedie k úhynu rýb, kontaminuje aj podzemné vody, okrem toho súvisí so vznikom chorôb dýchacie.
Okrem tohto poškodenia životného prostredia reagujú kyslé dažde s uhličitanmi, ako je mramor (vápenec – uhličitan vápenatý – CaCO3), ktoré tvoria sochy, historické pamiatky a mnohé materiály používané v občianskej výstavbe, ktoré časom degradujú. Reagujú aj s kovmi, pričom ničia kovové konštrukcie v budovách a mostoch.

Vápencová stena skorodovaná časom a kyslými dažďami
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-chuva-acida.htm
