Kps je skratka používaná na označenie konštanta produktu rozpustnosti, ktorý odkazuje na produkt (násobenie) koncentrácie v množstve hmoty iónov prítomných v roztoku.
Kedykoľvek sa do rozpúšťadla, ako je síran bárnatý, pridá zle rozpustná rozpustená látka, pridá sa malé množstvo časť tejto soli sa rozpustí vo vode a zvyšok sa hromadí na dne nádoby a vytvára telo pozadie. Soľ, ktorá sa rozpúšťa, trpí disociácia, pričom do vody uvoľňujú katióny a anióny.

Zrazenina sa nachádza v roztoku s vodou a síranom bárnatým
Okrem toho soľ nepredstavuje dobre rozpustnosťsa množstvo rozpustenej rozpustnej látky nemení v priebehu času, pretože medzi iónmi solí (prítomnými v roztoku) a základným telieskom je rovnováha rozpúšťania.

Zostatok na rozpustenie BaSO4 vo vode
Kps rozpustenej látky
O Kps rozpustenej látky je produktom molárnych koncentrácií zúčastnených iónov. Vždy je potrebné zvýšiť koncentráciu iónov na príslušný stechiometrický koeficient (používa sa na vyváženie rovnice).

Disolučná rovnováha elektrolytu YTheXB
O Kps navrhovanej rovnováhy pre soľ YTheXB bude mať koncentráciu činidla Y (zvýšenú na svoj stechiometrický koeficient (a) a koncentráciu produktu X (zvýšenú na svoj stechiometrický koeficient (b)).
Kps = [r+ b]The.[X-The]B
Príklad
Predpokladajme, že pripravujeme roztok s vodou a kyanidom hlinitým [Al (CN)3], čo je prakticky nerozpustná soľ vo vode. Keď sa táto soľ pridá do vody, nakoniec utrpí jav disociácie.

Al (CN) rovnováha rozpúšťania elektrolytov3
Takže prostredníctvom rovnice rovnováhy rozpúšťania solí máme tú jej Kps bude znásobovať koncentráciu katiónu hliníka (Al+3) zvýšený na exponent 1 koncentráciou kyanidového aniónu (CN-1) zvýšený na exponent 3.
Kps = [Al+3]1. [KN-1]3
Kps významy rozpustenej látky
Keď nájdeme Kps určitej soli zmiešanej s vodou poznáme aj koncentráciu každého z iónov v roztoku. Pomocou týchto údajov môžeme určiť poradie riešenia alebo správanie sa rozpustenej látky v roztoku. Zvážte nasledujúcu rovnováhu:

Disolučná rovnováha elektrolytu YTheXB
Môžeme nadviazať nasledujúce vzťahy:
Ak Kps = [Y+ b]The.[X-The]B = 0, máme nasýtený roztok bez prítomnosti zrazeniny;
Ak Kps> [Y+ b]The.[X-The]B = 0, máme nenasýtený roztok, to znamená malé množstvo rozpustenej látky rozpustenej v rozpúšťadle (vo vzťahu k koeficient rozpustnosti);
Ak Kps + b]The.[X-The]B = 0, máme nasýtený roztok so spodným telom, to znamená, že dôjde k vyzrážaniu elektrolytu (rozpustenej látky);
Ak je hodnota Kps elektrolytu príliš nízka, jedná sa o zle rozpustný materiál v rozpúšťadle.
Príklad Výpočet Kps rozpustenej látky
(UERN): Rozpustnosť dusičnanu vápenatého [Ca (NO3)2] vo vode je 2,0. 10–3 mol / liter pri určitej teplote. Kps tejto soli pri rovnakej teplote je:
a) 8.10–8.
b) 8.10–10.
c) 3.2.10–10
d) 3.2.10–8
Údaje o cvičení:
Vzorec soli: Ca (NO3)2;
Koncentrácia molárnej soli (rozpustnosť): 2,0. 10–3 mol / l.
Ak chcete vyriešiť a vypočítať Kps, musíte urobiť nasledovné:
Krok 1: Nastavte rovnováhu rozpúšťania solí.
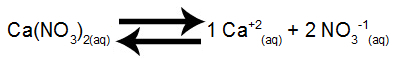
Rovnováha rozpúšťania dusičnanu vápenatého vo vode
Dusičnan vápenatý, keď prechádza disociáciou vo vode, uvoľňuje 1 mol vápnikových katiónov (Ca+2) a 2 mol dusičnanových aniónov (NO3-1).
Krok 2: Zostavte výraz Kps zo soli
Kps tejto soli bude produktom koncentrácie vápnikového katiónu zvýšeného na exponent 1 koncentráciou dusičnanového aniónu zvýšeného na exponent 2, ako je uvedené nižšie:
Kps = [Ca+2]1.[NA3-1]2
Krok 3: Stanovte hodnoty koncentrácií iónov v roztoku
Na výpočet Kps potrebujeme hodnoty koncentrácií iónov, avšak cvičenie poskytlo molaritu soli v roztoku. Na stanovenie koncentrácie každého iónu jednoducho vynásobte molaritu soli stechiometrickým koeficientom účastníka reakcie:
Pre vápnikový katión:
[Tu+2] = 1. 2,0. 10–3
[Tu+2] = 2,0. 10–3 mol / l
Pre dusičnanový anión:
[NA3-1] = 2. 2,0. 10–3
[NA3-1] = 4,0. 10–3 mol / l
Krok 4: Použite hodnoty koncentrácie zistené v kroku 3 vo vyjadrení Kps (určené v kroku 2).
Kps = [Ca+2]1.[NA3-1]2
Kps = [2,10-3]1.[4.10-3]2
Kps = 2,10-3.16.10-6
Kps = 32,10-9
alebo
Kps = 3.2.10-9 (mesiac / l)
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm
