Elektrolýza je fyzikálno-chemický proces, pri ktorom sa využíva elektrická energia z ktoréhokoľvek zdroja (ako napr batéria alebo batéria) na vynútenie výskytu chemickej reakcie na výrobu jednoduchých alebo zložených látok, ktoré sa v prírode nenachádzajú alebo ktoré sa nenachádzajú vo veľkých množstvách.
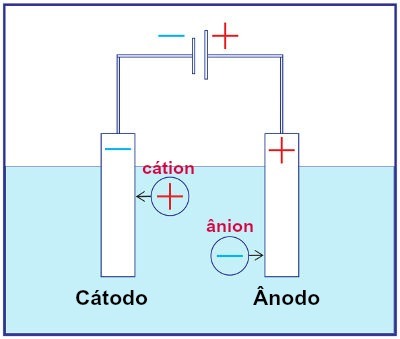
Zastúpenie montáže ľubovoľného elektrolýzneho systému
Počas elektrolýzy katión podlieha redukcii na katóde a anión oxiduje na anóde. To sa deje prostredníctvom elektrického výboja poskytovaného externým zdrojom. Pri elektrolýze teda máme spontánnu oxidačnú a redukčnú reakciu.
Teraz pochopte dva spôsoby, akými dochádza k elektrolýze:
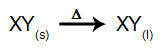
Pri tomto type elektrolýzy používame a iónová látka v kvapalnom stave v elektrolytickej kadi. Keď dôjde k fúzii iónovej látky (XY), dôjde k procesu disociácia, ako je znázornené nižšie:

Potom, keď je zapnutý zdroj energie, katión (X+) sa pohybuje smerom ku katóde a anióny (Y-) pohybujte sa smerom k anóde. Tým:
Na katóde: katióny prijímajú elektróny (prechádzajú redukciou) a transformujú sa na stabilnú látku (X), čo je proces predstavovaný nasledujúcou rovnicou:
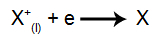
Na anóde: anióny strácajú elektróny (prechádzajú oxidáciou) a stávajú sa stabilnou látkou (X), čo je proces predstavovaný nasledujúcou rovnicou:

a) Príklad magmatickej elektrolýzy
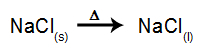
Ako príklad nasledujte teraz magmatickú elektrolýzu chlorid sodný (NaCl). Keď dôjde k fúzii chloridu sodného (NaCl), dôjde k procesu disociácie, ako je uvedené nižšie:
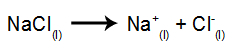
Potom, keď je zapnutý zdroj energie, katión (Na+) sa pohybuje smerom ku katóde a anióny (Cl-) pohybujte sa smerom k anóde. Tým:
Na katóde: katióny v+ prijímajú elektróny (prechádzajú redukciou) a stávajú sa stabilnou látkou (Na, čo je pevný kov), čo je proces predstavovaný nižšie uvedenou rovnicou:

Na anóde: Cl anióny- strácajú elektróny (prechádzajú oxidáciou) a stávajú sa stabilnou látkou (Cl2, ktorý je plynný), proces predstavovaný nižšie uvedenou rovnicou:

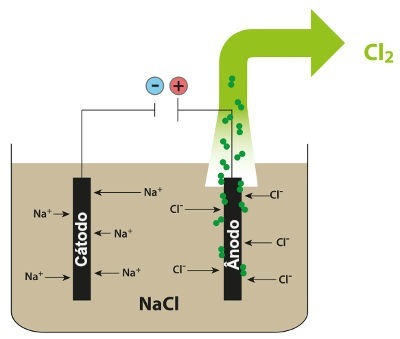
Schéma demonštrujúca magmatickú elektrolýzu NaCl
Pri magmatickej elektrolýze chloridu sodného teda vzniká kovový sodík (Na) a plynný chlór (Cl2).
Pri tomto type elektrolýzy používame vo vnútri elektrolytickej nádrže iónovú látku rozpustenú vo vode. Pred elektrolýzou teda najskôr zmiešame látku (zvyčajne soľ anorganické) vo vode spôsobiť jeho disociáciu (uvoľnenie katiónu a aniónu), ako je znázornené nižšie:
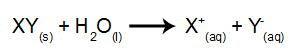
Rozdiel vo vzťahu k magmatickej elektrolýze spočíva v tom, že okrem iónov z disociácie máme aj ióny zo samoionizácie vody. Pri svojej samoionizácii voda produkuje hydróniový katión (H+) a hydroxidový anión (OH.)-), ako je uvedené v rovnici nižšie:

Vo vnútri elektrolytickej nádrže teda máme prítomnosť dvoch katiónov (jeden z látky) iónový a jeden z vody) a dva anióny (jeden z iónovej látky a druhý z Voda).
Aby ste vedeli, ktorý katión sa bude pohybovať na katódu a ktorý anión sa bude pohybovať na anódu, je potrebné poznať poradie vypúšťania katiónov a aniónov.
Pre katióny:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hydronium> rodina IIIA> rodina IIA> rodina IA
pre anióny
Neokysličené anióny a HSO4 > hydroxid> okysličené anióny a F
Keď je potom zdroj napájania zapnutý, katión (X+) sa pohybuje smerom ku katóde a jeden z aniónov (Y-) sa pohybuje smerom k anóde.
Na katóde: katióny prijímajú elektróny (prechádzajú redukciou) a transformujú sa na stabilnú látku (X), čo je proces predstavovaný nižšie uvedenou rovnicou:

Na anóde: anióny strácajú elektróny (prechádzajú oxidáciou) a menia sa na stabilnú látku (Y), čo je proces predstavovaný nižšie uvedenou rovnicou:
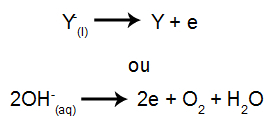
a) Príklad vodnej elektrolýzy
Ako príklad použijeme vodnú elektrolýzu chloridu sodného (NaCl). Keď je chlorid sodný (NaCl) rozpustený vo vode, prechádza disociačným procesom, ako je uvedené nižšie:
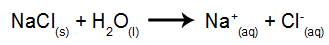
Okrem disociácie NaCl máme aj samoionizáciu vody:

Takže máme katióny H.+ a ďalej+ a OH anióny- a Cl-. Potom, keď je zdroj napájania zapnutý, máme nasledujúce:
na katóde: katióny H.+ prijímať elektróny (redukované) a stať sa stabilnou látkou (H2, čo je plyn). Je to tak preto, lebo hydrónium má výbojovú prioritu pred prvkami rodiny IA (v tomto prípade Na). Proces je znázornený nižšie uvedenou rovnicou:
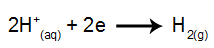
na anóde: anióny Cl- strácajú elektróny (prechádzajú oxidáciou) a stávajú sa stabilnou látkou (Cl2, ktorý je plynný). Je to preto, lebo kl- je to neokysličený anión a má prednosť pred hydroxidom, čo je proces predstavovaný nižšie uvedenou rovnicou:


Schéma demonštrujúca vodnú elektrolýzu NaCI
Pri vodnej elektrolýze chloridu sodného teda vzniká plynný vodík (H2) a plynný chlór (Cl2).
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm
