Redoxné reakcie zahŕňajú prenos elektrónov medzi atómami, iónmi alebo molekulami.
Pri oxidačno-redukčnej reakcii dochádza k zmenám v oxidačnom čísle (nox). Oxi-redukcia pozostáva z oxidačných a redukčných procesov:
- Oxidácia: výsledky v strata elektrónov a zvýšil nox.
- Zníženie: výsledky v elektrónový zisk a znížená nox.
Keď sa jeden prvok vzdá elektrónov, ďalší ich prijme. Celkový počet prijatých elektrónov sa teda rovná celkovému počtu stratených elektrónov.
Príklady redoxných reakcií na horenie, koróziu a fotosyntézu.
Príklady
V závislosti od prvku, ktorý prijíma alebo daruje elektróny, máme nasledujúce názvy:
- Redukčné činidlo: Ten, ktorý podstúpi oxidáciu, spôsobí zníženie a zvýši číslo NOX. Je to to, čo stráca elektróny.
- Oxidačné činidlo: Ten, ktorý podstúpi redukciu, spôsobí oxidáciu a znížil číslo NOX. To je to, čo získava elektróny.
O oxidačné číslo predstavuje elektrický náboj prvku v čase, keď sa podieľa na a chemická väzba.
Táto podmienka súvisí s elektronegativita, čo je tendencia niektorých prvkov prijímať elektróny.
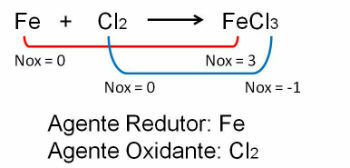
1. Pozorujte prvý príklad, všimnite si, že pri reakcii medzi železom a chlórom dochádza k zmene oxidačného čísla. O chlór pretože je elektronegatívnejší, získava elektróny:
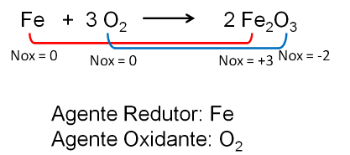
2. Reakcia medzi železom a kyslíkom. Kyslík je elektronegatívnejší a končí prijímaním elektrónov a znižovaním ich oxidačného čísla.
Viac informácií, prečítajte si tiež:
- Oxidácia
- Spaľovanie
- Chemické reakcie
- elektróny
Cvičenie vyriešené
1. (PUC-RS) Vo vzťahu k oxidačnej rovnici - nevyvážená redukcia Fe0 + CuSO4 → Fe2(IBA4)3 + Cu0, dá sa povedať, že:
a) oxidačné číslo medi v síranu meďnatom je +1.
b) atóm železa stratí 2 elektróny.
c) meď podlieha oxidácii.
d) železo je oxidačné činidlo.
e) železo podlieha oxidácii.
Rozhodnutie:
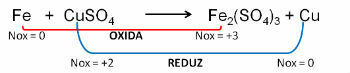
Odpoveď:
e) železo podlieha oxidácii.
Cvičenia
1. (UFAC-AC) V nasledujúcej chemickej rovnici: Zn + 2 HCℓ → ZnCℓ2 + H2
a) prvok Zn oxiduje a reaguje ako oxidačné činidlo.
b) Zn prvok oxiduje a reaguje ako redukčné činidlo.
c) Zn prvok redukuje a reaguje ako redukčné činidlo.
d) HC3 je redukčné činidlo.
e) rovnica je klasifikovaná ako reverzibilná.
b) Zn prvok oxiduje a reaguje ako redukčné činidlo.
2. (ITA-SP) V iónovej reakcii Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (y)
a) nikel je oxidačné činidlo, pretože sa oxiduje.
b) nikel je reduktor, pretože je oxidovaný.
c) meďnatý ión je oxidátor, pretože sa oxiduje.
d) meďnatý ión je reduktor, pretože je redukovaný.
e) nejde o redoxnú reakciu, preto tu nie je žiadne oxidačné činidlo alebo redukčné činidlo.
b) nikel je reduktor, pretože je oxidovaný.
3. (UFRGS) Účinnou látkou v bielidle pre domácnosť je chlórnanový ión, ClO-. V bieliacich procesoch je tento ión redukovaný; To znamená, že:
a) látka, ktorá podlieha pôsobeniu chlórnanu, prijíma elektróny.
b) dochádza k poklesu počtu elektrónov v jeho štruktúre.
c) ClO- je redukčné činidlo.
d) ClO- sa prevádza na elementárny chlór alebo chloridový ión.
e) nedochádza k prenosu elektrónov.
d) ClO- sa prevádza na elementárny chlór alebo chloridový ión.



