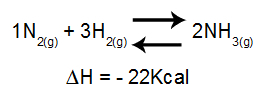Hybridizácia je názov spájaný alebo spájajúci neúplné atómové orbitaly, jav, ktorý zvyšuje počet Kovalentné väzby že atóm dokáže. Pamätajúc na to, že orbitálna je oblasť atómu, kde je väčšia pravdepodobnosť nájdenia elektrónu.
Poznať počet väzieb, ktoré atóm vytvára, a porozumieť javu hybridizácia, je potrebné poznať niekoľko základných bodov o atóme:
1O bod: energetická úroveň
Energia môže mať podúrovne s, p, d, f.
2O bod: počet orbitálov na podúrovni
Každá podúroveň energie má iné množstvo orbitalov, ako vidíme nižšie:
Podúroveň s: 1 orbitálna;
p podúroveň: 3 orbitaly;
Podúroveň d: 5 orbitálov.
Všeobecná reprezentácia týchto orbitálov sa vykonáva nasledovne:

Reprezentácia orbitalov každej podúrovne
Podľa Pauliho orbital môže mať najviac 2 elektróny s točí sa (rotačné pohyby) oproti.

Reprezentácia orbitálu s jeho elektrónmi
Podľa Hunda obežná dráha podúrovne prijíma svoj druhý elektrón až vtedy, keď už všetky ostatné orbity tejto podúrovne dostali prvý elektrón.

Distribúcia elektrónov na p podúrovňových orbitáloch
3O bod: elektronická distribúcia
Aby sme pochopili hybridizáciu a počet väzieb, ktoré atóm vytvára, je nevyhnutné uskutočniť elektronická distribúcia na diagrame Linusa Paulinga.

Schéma Linusa Paulinga
Pamätajte, že maximálny počet elektrónov v každej nižšej úrovni je:
s = 2 elektróny;
p = 6 elektrónov;
d = 10 elektrónov;
-
f = 14 elektrónov.
Teraz neprestávajte... Po reklame je toho viac;)
Po tejto krátkej kontrole to môžeme definovať teraz čo je hybridizácia. Na tento účel použijeme chemický prvok bór (atómové číslo = 5) ako príklad.
Keď vykonávame elektronickú distribúciu bóru, máme:

Elektronická distribúcia bóru v Linus Paulingovom diagrame
Pri tejto distribúcii je možné pozorovať, že bór má 2 elektróny v podúrovni s a 1 elektrón v podúrovni p valenčná vrstva.

Elektróny na orbitáloch bočnej valenčnej vrstvy
Pretože bór má 1 neúplný orbitál, mal by vytvárať iba jednu kovalentnú väzbu, pretože počet väzieb vždy priamo súvisí s počtom neúplných orbitálov.
Keď teda atóm bóru prijíma energiu z vonkajšieho prostredia, jeho elektróny, najmä tie vo valenčnej škrupine, sa vzrušujú. To spôsobí, že jeden z elektrónov zo s orbitálu opustí a obsadí jeden z prázdnych p orbitálov, čo má za následok 3 neúplné atómové orbitaly, ako vidíte na nasledujúcom obrázku:

Reprezentácia excitovaného stavu atómu bóru
Nakoniec dôjde k spojeniu neúplného orbitálu s neúplnými p orbitálmi. Táto únia sa nazýva hybridizácia. Pretože máme fúziu s obežnej dráhy s dvoma p, nazýva sa to hybridizácia sp2.

Zastúpenie hybridizovaných orbitálov v atóme bóru
Okrem bóru podlieha fenomén hybridizácie aj niekoľko ďalších chemických prvkov, ako je síra (S), xenón (Xe), fosfor (P), uhlík (Ç), berýlium (Buď).
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Čo je to hybridizácia?“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm. Sprístupnené 27. júna 2021.
Väzbová energia, Chemické reakcie, lámanie väzieb, štúdium variácií energie, entalpické variácie reakcií, dodávka energie, prerušenie spojenia činidiel, endotermický proces, uvoľnenie energie, energia uvoľnená v tvorenie