Lorenzo Romano Amedeo Carlo Avogadro (1776-1856) bol taliansky chemik, ktorý ako prvý vytvoril myšlienku, že vzorka prvku, ktorého hmotnosť v gramoch sa číselne rovná jeho atómovej hmotnosti, má vždy rovnaký počet atómov (N).
Samotný Avogadro nebol schopný určiť hodnotu N. Avšak v priebehu dvadsiateho storočia pokrok v oblasti technológií a vedeckých poznatkov umožnil ďalším vedcom vyvinúť techniky na ich stanovenie. Keď bola táto hodnota konečne objavená, volala sa Avogadrova konštanta, na počesť tohto vedca, pretože to bol on, kto položil základy jeho vzniku.

Lorenzo Romano Amedeo Carlo Avogadro (1776-1856)
V 1 móle ktorejkoľvek entity (atómy, molekuly, elektróny, vzorce alebo ióny) je obsiahnutá presne hodnota Avogadrovej konštanty.
V nasledujúcej tabuľke sú uvedené niektoré hodnoty konštanty Avogadra získané počas 20. storočia:
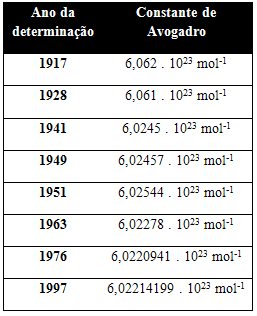
Tu sú niektoré z techník použitých na pokus o určenie hodnoty Avogadrovej konštanty:
Prvým vedcom, ktorý urobil približný výpočet pre Avogadrovu konštantu, bol Johann Joseph Loschmidt. V roku 1867 vychádzal z kinetickej teórie plynov a určil, koľko molekúl existuje v 1 cm
3 plynu.Ďalším z týchto vedcov bol Francúz Jean Baptiste Perrin (1870-1942), ktorý spočítal počet koloidných častíc na jednotku objemu v suspenzii a zmeral ich hmotnosti. Hodnota, ktorú zistil, sa pohybovala medzi 6,5 a 7,2. 1023 subjektov na mol. Tento vedec vydal knihu v roku 1913 Les Atomes (1. vyd. Paris: Alcan) a jej 9. vydanie, vydané v roku 1924, obsahovalo 16 spôsobov, ako experimentálne získať Avogadrovu konštantu.
Teraz neprestávajte... Po reklame je toho viac;)

Jean Baptiste Perrin (1870-1942)
Vedec James Dewar (1842-1923) po rokoch použil metódu vyvinutú pred rokmi rádiochemikom Bertramom Boltwoodom (1870-1927) a fyzikom Ernestom Rutherford (1871-1937), ktorá v zásade spočívala v spočítaní alfa častíc emitovaných rádioaktívnym zdrojom a určení objemu získaného hélia. Hodnota zistená Dewarom bola 6,04. 1023 mol-1.
Ešte v 20. storočí Robert Millikan (1868-1953) uskutočnil experiment na stanovenie náboja elektrónu (1.6. 10-19 Ç). Pretože náboj 1 mólu elektrónov už bol známy (96 500 C), bolo možné dať tieto dve hodnoty do súvislosti a nájsť pre Avogadrovu konštantu nasledujúcu hodnotu: 6,03. 1023 mol-1.
V súčasnosti je odporúčaná hodnota pre Avogadrovu konštantu 6,02214 x 1023 mol-1 a stanoví sa pomocou röntgenovej difrakcie, pri ktorej sa získa objem niekoľkých atómov kryštalickej mriežky, pokiaľ je známa hustota a hmotnosť 1 mólu atómov vo vzorke.
Z didaktických dôvodov, na strednej škole, kde výpočty nemusia byť také presné ako výpočty vykonané v chemických laboratóriách, sa Avogadrova konštanta považuje za 6,02. 1023 mol-1.
Existujú aj jednoduchšie metódy, ktoré pomôžu študentom určiť Avogadrovu konštantu v praxi. Jedným z nich je elektrolýza vo vodnom prostredí.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Stanovenie Avogadrovej konštanty“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/determinacao-constante-avogadro.htm. Prístup k 28. júnu 2021.


