Oxidačno-redukčná reakcia je charakterizovaná ako simultánny proces straty a zisku elektrónov, pretože elektróny stratené atómom, iónom alebo molekulou sú okamžite prijímané ostatnými.
Ak chcete pochopiť, pozrite si príklad:
Roztok síranu meďnatého (CuSO4 (aq)) je modrý kvôli prítomnosti Cu iónu2+ rozpustený v ňom. Keby sme dali kovový zinkový plech (Zns) v tomto roztoku si môžeme v priebehu času všimnúť dve zmeny: farba roztoku bude bezfarebná a na zinkovej platni sa objaví kovová medená usadenina.
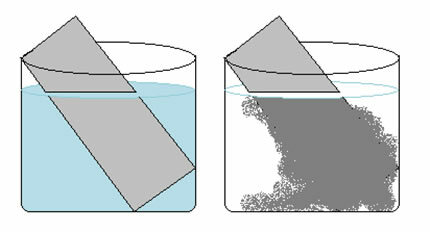
Preto je reakcia, ktorá nastane v tomto prípade, nasledovná:
Zns + CuSO4 (aq) → Cus + ZnSO4 (aq)
alebo
Zns + Cu2+(tu) + OS42-(tu) → Cus + Zn2+(tu) + OS42-(tu)
alebo ešte
Zns + Cu2+(tu) → Cus + Zn2+(tu)
Všimnite si, že došlo k prenosu elektrónov zo zinku na meď. Izolovanou analýzou transformácie, ku ktorej došlo v každom z týchto prvkov, máme:
- Zns → Zn2+(tu)
Zinok stratil 2 elektróny prechádzajúce z kovového zinku do katiónu. V tom prípade, zinok bol oxidovaný.
- Ass2+(tu) → Cus
S meďou sa stal pravý opak, získal 2 elektróny a prešiel z katiónu medi II do kovovej medi. Meď bola zmenšená.
To vysvetľuje dve pozorované zmeny, pretože roztok sa stal bezfarebným, pretože ióny medi sa transformovali na kovovú meď, ktorá sa ukladala na zinkovej doske.
Teraz neprestávajte... Po reklame je toho viac;)
Pretože došlo k súčasnej strate a zisku elektrónov, je táto reakcia príkladom redoxnej reakcie, a prostredníctvom nej môžeme ustanoviť nasledujúce koncepty, ktoré sa opakujú pre všetky ďalšie reakcie tohto typ:

Najreaktívnejší kov podlieha oxidáciiV navrhovanom príklade je teda zinok reaktívnejší ako meď.
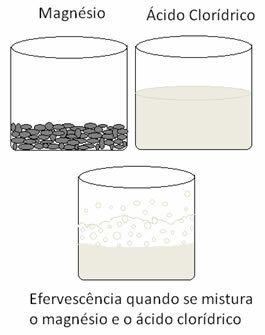
Ďalšia redoxná reakcia, ktorú možno citovať, nastáva, keď do roztoku kyseliny chlorovodíkovej vložíme horčík alebo hliník. Pri týchto reakciách vodík z kyseliny chlorovodíkovej prijíma 3 elektróny z hliníka (alebo 2 elektróny z horčíka) a odovzdáva ho z katiónu H+ pre plynný vodík (H2), zatiaľ čo kov sa stáva katiónom:
2 Als + 6 H+(tu) → 2 Al3+(tu) + 3H2 písm. G)
mgs + 2 H+(tu) → Mg2+(tu) + H2 písm. G)
Kovy prechádzajú oxidáciou a vodík redukciou. Ďalej je uvedený obrázok, ktorý ukazuje, že pridanie horčíka k kyseline chlorovodíkovej spôsobuje a šumenie, ktoré je dôsledkom uvoľňovania plynného vodíka, a horčík zmizne taký, aký je spotrebované.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Oxidačné reakcie“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm. Prístup k 28. júnu 2021.
Chémia
Obsluha airbagu, zariadenie určené na ochranu vodičov, elektrický impulz, reakcia chemického rozkladu, kolízia, chemická zmes azidu sodného, senzory umiestnené na nárazníku automobilu, kremičitan alkalický, plyn dusík.
Chémia

Fotocitlivé šošovky, oxidačno-redukčné reakcie, strata alebo zisk elektrónov, fotosyntetické šošovky v slnečných okuliaroch, zloženie fotochromatického skla, štvorboké atómy kyslíka, kryštalická štruktúra chloridu strieborného, ultrafialové svetlo, strieborný kov


