* Arrheniova teória:
Na základe jeho experimentov s elektrickou vodivosťou vo vodnom prostredí, chemických, fyzikálnych a matematických Švéd Svante August Arrhenius (1859-1927) navrhol v roku 1884 nasledujúce pojmy na definíciu kyselín a základy:

Všeobecne teda máme:
H+ + H2O → H3O+
Príklady:
HCl + H2O → H3O++ Cl-
HNO3+ H2O → H3O+ + NIE3-
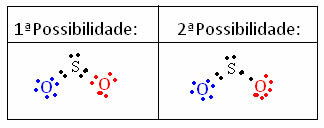
H2IBA4+ 2 H2O → 2H3O+ + OS42-

Príklady:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
* Brönsted-Lowryho teória:
Nezávisle sú to Dán Johannes Nicolaus Brönsted (1879-1947) a Angličan Thomas Martin Lowry (1874-1936), v tom istom roku navrhol ďalšiu acidobázickú teóriu známu ako Brönsted-Lowryho teória, ktorá hovorí Nasledujúci:

V tomto prípade sa vodíkový ión považuje za protón. Je to vidieť na nasledujúcej reakcii, keď kyselina kyanovodíková daruje protón do vody, ktorá preto pôsobí ako báza:
HCN + H2O → CN- + H3O+
Táto reakcia je reverzibilná s hydróniovým iónom (H3O+) môže darovať protón iónu CN-. Hydróniový ión (H3O+) pôsobí ako kyselina a CN- ako základ.
KN- + H3O+→ HCN + H2O
* Lewisova teória:
Túto teóriu vytvoril americký chemik Gilbert Newton Lewis (1875-1946) a hovorí nasledovné:

Teraz neprestávajte... Po reklame je toho viac;)
Táto teória zavádza nový pojem, je komplexnejšia, ale nevyvracia Brönsted-Lowryho teóriu. Pre každú Lewisovu kyselinu predstavuje Brönstedova kyselina, a preto je každá Lewisova zásada Brönstedovou zásadou. Je to tak preto, lebo protón prijíma elektróny, čo znamená, že Lewisova kyselina sa môže pripojiť k voľnému páru elektrónov v Lewisovej báze.
Pre Lewisa spočíva acidobázická reakcia v tvorbe stabilnejšej koordinovanej kovalentnej väzby. Takže keď Lewisova báza daruje pár elektrónov na Lewisovej báze, obidve tvoria a súradnicová kovalentná väzba, v ktorej oba elektróny pochádzajú z jedného z atómov, ako v príklade nižšie:

V tomto prípade amoniak funguje ako Lewisova a Brönstedova báza, pretože daruje svoje dva elektróny protónu, a je teda prijímačom protónu. Okrem toho sa vytvorila kovalentná väzba medzi vodíkom (protónom) a amoniakom.
Voda je Lewisova kyselina a Brönstedova kyselina, pretože daruje protón a prijíma elektróny. Všimnite si, že kyslík v hydroxide vytvorenom z vody má ďalší pár elektrónov.

Autor: Jennifer Fogaça
Vyštudoval chémiu
Brazílsky školský tím.
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Arrhenius, Brönsted-Lowry a Lewisova acidobázická teória“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm. Prístup k 28. júnu 2021.