Existujú tri typy alkadiénov alebo diénov, ktoré sú:
1 akumulované: Dvojité väzby sú umiestnené na rovnakom uhlíku a objavujú sa postupne:
─C ═ Ç ═ C ─
│ │
2- Izolované: Dvojité väzby sú na rôznych uhlíkoch a sú oddelené najmenej dvoma po sebe nasledujúcimi jednoduchými väzbami:
│
─C ═ C C ─ C ═ C ─
│ │ │ │ │
3 - Konjugáty: Dvojité väzby sa objavujú striedavo a sú oddelené jednou jednoduchou väzbou:
─C ═ C C ═ C ─
│ │ │ │
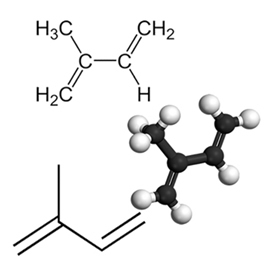
Príkladom dôležitého konjugovaného diénu je izoprén, ktorý je základnou jednotkou terpénovej skupiny, triedy organických zlúčenín. veľmi dôležité, niektoré príklady produktov tvorených izoprénmi sú guma, betakarotén (zodpovedný za oranžovú farbu produktu) mrkva), vitamín A a oleje z ovocných šupiek, semien, kvetov, listov, koreňov, zeleniny a dreva, ako je limonén a myrcén.
Do nahromadení a izolovaní dieni, vyskytujú sa adičné reakcie rovnako ako v prípade alkénov, čomu môžete porozumieť čítaním textu Sčítacie reakcie. Rozdiel je iba v tom, že tento druh dvojitej reakcie podstupujú diény, pretože majú dve dvojité väzby, zatiaľ čo alkény iba jednu dvojnú väzbu.
Avšak v prípade združené diény, adičná reakcia má zvláštnosť, pretože tieto zlúčeniny môžu podliehať rezonancii, takže adícia môže prebiehať dvoma spôsobmi:
1 - dodatok 1.2:
Toto sa považuje za normálne pridanie, pretože k pridávaniu dochádza na dvoch atómoch uhlíka, ktoré vytvárajú rovnakú dvojitú väzbu, to znamená na uhlíkoch 1 a 2:
Teraz neprestávajte... Po reklame je toho viac;)
H2Ç ═ CH─ CH ═ CH2 + HBr → H2C CH─ CH ═ CH2
│ │
HBr
Uvidíte, že tento typ reakcie nasleduje po Vláda Markovnikova, vodíkové väzby na hydrogenovanejší uhlík (s pripojeným väčším počtom atómov vodíka).
Prísada 1,2 sa spracuje pri nízkych teplotách (-60 ° C).
2 - dodatok 1.4:
V tomto prípade reakcia prebieha pri vysokých teplotách. Je dôležité zdôrazniť, že sa vždy vytvorí produkt pridania 1,2 aj prídavok 1,4, ale teplota naznačuje, ktoré sa budú vytvárať vo väčšom množstve.
Nasleduje príklad pridania typu 1.4:
H2Ç ═ CH─ CH ═ CH2 + HBr → H2C CH ═ CH─CH2
│ │
HBr
Všimnite si, že nastane nasledujúci jav, jeden zo zdieľaných elektrónov v pi väzbe každého z dvojitých uhlíkov sú spoločné so substituentom a ostatné tvoria novú dvojitú väzbu medzi ostatnými uhlíkmi:
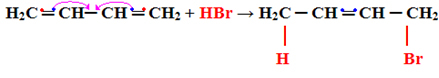
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Adičné reakcie v diénoch“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/reacoes-adicao-dienos.htm. Prístup k 28. júnu 2021.