Roztok je homogénna zmes dvoch alebo viacerých látok.. Ako napríklad roztok soli (rozpustenej látky) rozpustenej vo vode (rozpúšťadlo).

Najmä v chemických laboratóriách a priemysle je tento proces veľmi dôležitý, pretože chemik musí pripraviť roztoky so známymi koncentráciami. Ďalej sa pri experimentálnych činnostiach používajú roztoky s veľmi nízkymi koncentráciami, takže sa vzorka koncentrovaného roztoku zriedi na požadovanú koncentráciu.
Denne, niekoľkokrát, bez toho, aby sme si to uvedomovali, uskutočňujeme proces riedenia roztokov. Napríklad balenie čistiacich a hygienických výrobkov, napríklad dezinfekčných prostriedkov, odporúča, aby sa pred použitím zriedili. Niektorí výrobcovia odporúčajú na etiketách výrobkov, aby sa riedil vodou v pomere 1 až 3, to znamená, že pre každú časť produktu je potrebné pridať 3 diely vody. Je to tak preto, lebo produkt je veľmi koncentrovaný a silný a môže sa poškodiť na mieste, kde bude nanesený, ak nebude správne zriedený. Na druhej strane, ak ho zriedite viac, ako by malo, môžete prísť o peniaze, pretože produkt nedosiahne požadovaný výsledok.

Ďalším príkladom je, keď vyrábame džúsy. Štítky mnohých koncentrátov šťavy naznačujú, že pohár šťavy by sa mal zriediť alebo zmiešať s 5 pohármi vody. Šťava sa tak stáva „slabšou“, teda menej koncentrovanou.
Teraz neprestávajte... Po reklame je toho viac;)
Predstavte si, že ste taký džús zriedili v 3 L vody. Ak bola počiatočná koncentrácia šťavy 40 g / l, znamená to, že mala hmotnosť 40 g na každý liter rozpúšťadla. Ale keďže budeme mať 3 L, hmotnosť sa vydelí 3 a koncentrácia bude potom približne 13, 33 g / l alebo 13 gramov na každý liter roztoku. V celom roztoku však stále zostáva hmotnosť 40 g rozpustenej látky.
Výpočet tejto novej koncentrácie je možné vykonať nasledovne:
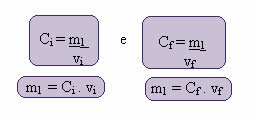
Kde indexy i a f predstavujú počiatočnú a konečnú hodnotu. Pretože sa hodnota m1 nezmenila, môžeme rovnice vyrovnať:
Çi. vi = C.f. vf
Pri nahradení hodnôt, ktoré máme, si podľa predchádzajúceho príkladu všimnite:
Počiatočné riešenie:
Çi: 40 g / l
ml: 40 g
vi: 1L
Konečné riešenie:
Çf: ?
ml: 40 g
vf: 3L
Çi. vi = C.f. vf
(40 g / l). (1 1) = Cf. 3L
Çf = 40 g / l
3
Çf = 13,333 g / l
Rovnaké zdôvodnenie platí aj pre molárnu koncentráciu (M) a pre hmotnostné percento rozpustenej látky alebo titra (T):
Mi. vi = M.f. vf a Ti. vi = Tf. vf
Autor: Jennifer Fogaça
Vyštudoval chémiu
Brazílsky školský tím
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Riedenie roztokov“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm. Sprístupnené 27. júna 2021.



