O medzimolekulové sily, všeobecne nazývané Van der Waalsove sily, sú tam tri: indukovaný dipól indukovaný dipólom, vodíkové väzby a permanentný dipól - permanentný dipól. V tomto texte zvážime iba poslednú z týchto troch síl:
Sila permanentný dipól-permanentný dipólalebo jednoducho dipól-dipól vyskytuje sa iba v polárne molekuly, teda tých, ktoré nemajú rovnomerné rozloženie zaťaženia po jeho povrchu. Uvedieme príklad, že v molekule HCl (plynný chlorovodík) je elektronický mrak viac posunutý smerom k atómu chlóru, pretože je elektronegatívnejší ako vodík.
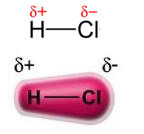
Všimnite si, že okolo atómu chlóru dochádza k akumulácii elektrónov, čo spôsobuje tvorbu a záporný pól, ktoré je symbolizované gréckym písmenom delta (-δ). Výsledkom je, že v oblasti okolo atómu vodíka a kladný pól (+δ), pretože má nízku elektronickú hustotu. Molekula HCl potom predstavuje a elektrický dipól a preto pri kontakte s ostatnými susednými molekulami HCl existuje príťažlivá sila medzi opačnými pólmi molekúl, ako je možné vidieť nižšie:
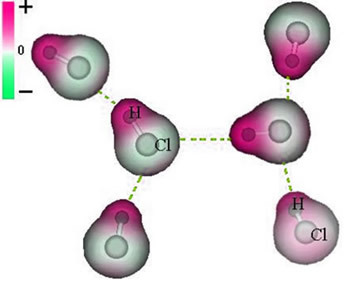
Táto atraktívna sila, ktorá sa vytvára medzi negatívnym koncom dipólu jednej molekuly s pozitívnym koncom dipólu inej molekuly, predstavuje silu dipól-dipól..
Ako hovorí názov, dipól je teda trvalý, takže sa vyskytuje iba v polárnych zlúčeninách. A čím vyššia je polarita molekuly, tým intenzívnejšie sú dipól-dipólové interakcie v látke.
Ak je v pevnej fáze, vedie tvorba permanentného dipólu pozíciu každej molekuly v priestore a formuje sa dipolárne kryštály; ako v prípade bromovodíka znázorneného nižšie:
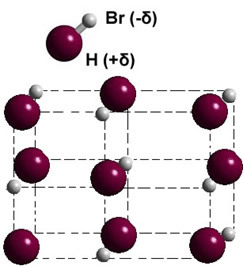
Ďalšie príklady polárnych látok, ktoré majú medzi molekulami silu dipólu a dipólu, sú: H2S, CO, HCCI3, IBA2.
Táto medzimolekulová sila je stredná intenzita, pretože je silnejšia ako indukčná dipólom vyvolaná príťažlivá sila dipólu, ale menej intenzívna ako vodíková väzba. Preto sú ich teploty topenia a varu vyššie ako u látok, ktoré majú indukovanú silu dipólu. Pretože je permanentná dipólová sila silnejšia, je potrebné dodať viac energie na to, aby sa narušili interakcie jeho molekúl.
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm
